1. Equilibrios de disociación de ácidos y bases
Ya sabes que los ácidos y las bases fuertes están disociados totalmente, mientras que si son débiles el grado de disociación es pequeño.
Pero ¿esto es cierto siempre? En las disoluciones de HCl muy concentradas, el grado de disociación no es del 100%, porque se forman pares iónicos debido a la elevada concentración de iones en la disolución, que hace que estén muy cerca y se unan. En las disoluciones con las que vas a trabajar, con concentraciones del orden de 1 mol/L o menos, la disociación es total, y no tendrás en cuenta la existencia de pares iónicos.
Pero ¿y si el ácido fuerte está muy diluido? Fíjate en el ejercicio resuelto siguiente.
 |
| Imagen 2 Elaboración propia |
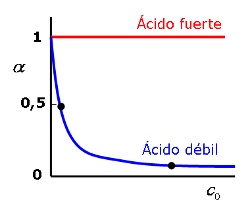
Por otro lado, en los ácidos o bases débiles se observa que el grado de ionización es mayor cuanto menor es la concentración de la sustancia. Para ello, no hay mas que determinar la composición en el equilibrio, sabiendo la concentración de la disolución de ácido y la constante de equilibrio.
Fíjate en la gráfica y verás que el grado de disociación se acerca a la unidad (el 100%) a concentraciones muy pequeñas, mientras que en el ácido fuerte siempre es la unidad (si la concentración no es muy grande, como ya has visto).
Para realizar un tratamiento exacto del equilibrio de un ácido o de una base débil es necesario considerar también el equilibrio de disociación del agua, que presenta el efecto del ión común con el ácido o la base a través de los iones H3O+ ó OH-. En ambos casos, aun siendo débil el ácido podrás despreciar la concentración inicial iónica del agua (10-7). De todos modos, al obtener el resultado final puedes comprobar que la aproximación que has hecho es correcta.
El equilibrio ácido-base en ácidos polipróticos
Algunos ácidos débiles son polipróticos, esto es, contienen más de un átomo de hidrógeno ionizable. Dichos ácidos se ionizan en etapas con una constante de equilibrio para cada una de ellas. Por ejemplo, el ácido fosfórico, un componente habitual de los refrescos de cola, es un ácido triprótico:
| H3PO4 + H2O ↔ H2PO4- + H3O+ | 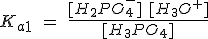
|
| H2PO4- + H2O ↔ HPO42- + H3O+ | |
| HPO42- + H2O ↔ PO43- + H3O+ | 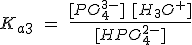
|
El comportamiento del ácido fosfórico es típico de todos los ácidos polipróticos:
- Los aniones intermedios formados (H2PO4-, HPO42- ) son especies anfóteras y producen un ión H3O+ en la siguiente etapa.
- La constante de equilibrio del ácido va decreciendo en cada etapa sucesiva: Ka1 > Ka2 > Ka3.