2. El pH de disoluciones de sales
|
|
| Simulación 1 Greenbowe, Uso educativo |
Marca cada una de las sales de los grupos Salt I, Salt II y Salt III, con una concentración 10 10-2 M y un volumen de 20 mL, que resulta suficiente para hacer las medidas. Introduce los sensores en la disolución y anota el valor del pH para cada sal, sacándolos para pasar a la sal siguiente (¡seguro que no tienes problemas con el inglés que se utiliza en el simulador!).
Clasifica las sales en tres grupos: las que producen un pH ácido, las que dejan el pH neutro y las que dan lugar a pH básico.
Las disoluciones de algunas sales neutras (que no contienen H ni grupos OH), contrariamente a lo que podrías suponer a primera vista, presentan carácter ácido o básico. Así, por ejemplo, cuando se disuelve en agua acetato de sodio, la disolución resultante es básica. En cambio, la disolución de cloruro de amonio es ácida. ¿Cómo puedes explicar el distinto comportamiento de estas disoluciones?
Recuerda que una sal es un sólido iónico que contiene un catión distinto de un H+ y un anión distinto de OH- o de O2-. Cuando una sal soluble se disuelve en agua, sus iones se liberan de la red cristalina:
KCl (s) 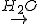 K+ (aq) + Cl- (aq)
K+ (aq) + Cl- (aq)
Na2CO3 (s) 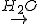 2 Na+ (aq) + CO32- (aq)
2 Na+ (aq) + CO32- (aq)
Muchos iones son ácidos o bases de Brönsted-Lowry y reaccionan con el agua cediendo o aceptando protones. De hecho, muchas veces el soluto utilizado para preparar una disolución ácida o básica es una sal.
El comportamiento ácido o básico de las disoluciones acuosas de sales neutras se debe a que al menos uno de los iones de la sal reacciona con el agua, lo que recibe el nombre de hidrólisis. Literalmente, hidrólisis significa "rompimiento por medio del agua".
En la teoría de Brönsted-Lowry, la hidrólisis es simplemente una reacción del tipo ácido-base, en la que un anión (base) reacciona con el agua (que actúa como ácido), o bien un catión (ácido) reacciona con el agua (que actúa como base). Por ello, aunque se conserva por tradición el nombre de hidrólisis, ésta no requiere un tratamiento especial desde el punto de vista teórico.
¿Cómo puedes predecir si la disolución en agua pura de una determinada sal será ácida, básica o neutra)? Para ello, debes escribir la reacción de disoación de la sal en sus correspondientes iones. Después, sigue los siguientes pasos:
- Determina qué efecto tendrá el catión sobre el pH de la disolución.
- Determina qué efecto tendrá el anión sobre el pH de la disolución.
- Decide cuál de los efectos anteriores es el predominante (no te vas a encontrar con casos en los que los dos iones se hidrolicen).