1.2 Valoración e indicadores
El problema de una valoración ácido-base consiste en determinar el punto de neutralización o punto en el que el ácido (o la base) neutraliza totalmente a la base (o al ácido). Ese punto también recibe el nombre de punto de equivalencia, pero se trata de una terminología que se recomienda no utilizar.
Recuerda que un indicador ácido-base es un ácido débil, con una constante de acidez Ka (o una base débil, Kb). El cambio neto de color del indicador se conoce como viraje y la banda de pH que corresponde al cambio de color se conoce como intervalo de viraje. Debes tener presente que el intervalo de viraje de los indicadores está próximo a su pKa o pKb y varía aproximadamente en dos unidades (ΔpH = pKa ± 1 ; ΔpH = pKb ± 1 ; ΔpH ≈ 2).
El punto de una valoración ácido-base en que el indicador experimenta un cambio de color perceptible y que persiste al menos durante 30 s se denomina punto final de la valoración. Es importante elegir el indicador con un punto final lo más próximo posible al punto de neutralización. De esta manera, el cambio de color del indicador se produce, justamente, en el punto de neutralización.
- Se han de utilizar pequeñas cantidades de indicador, ya que resultan suficientes para detectar el cambio de color 1 o 2 gotas de una disolución alcohólica del indicador al 0,1 %.
- El punto de neutralización de la valoración debe quedar comprendido dentro del intervalo de viraje del indicador, para así evitar los errores debidos a la no coincidencia del punto final con el punto de neutralización.
- Se toma como punto final el primer cambio de color neto detectable que permanezca durante 20 o 30 s.
Cambio de pH y elección de indicador
Las valoraciones ácido-base tienen su fundamento en el cambio brusco de la concentración de los iones H3O+ que se produce en el punto de neutralización.
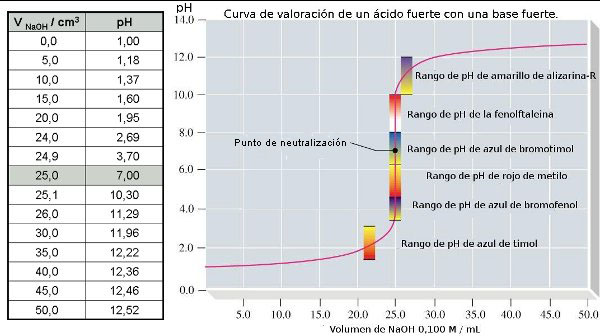
Vamos a ver esto con un ejemplo sencillo: la valoración de 25 cm3 de una disolución 0,100 M de HCl (en el erlenmeyer) con otra disolución 0,100 M de NaOH (se añade desde la bureta). Fíjate en la imagen siguiente: como la reacción de neutralización se produce mol a mol, la neutralización se producirá con 25 cm3 de disolución de NaOH 0,100 M.
|
| Imagen 3 Elaboración propia |
La concentración inicial de los iones H3O+ es 0,100 M (como es un ácido fuerte, la disociación es total) y, por tanto, su pH es 1,0. Al ir añadiendo disolución de NaOH, se va neutralizando el HCl, pero el pH varía muy poco como se aprecia en la imagen. Así, por ejemplo, cuando se han añadido 24 cm3 de disolución de NaOH, es decir, que falta por añadir 1 cm3 para llegar al punto de neutralización, se puede calcular que el pH es 2,69, como se indica en la tabla. Incluso, cuando sólo falta por añadir 0,1 cm3 de NaOH, el pH es 3,70. En el punto de neutralización el pH es 7. En cuanto se ha añadido 0,1 cm3 por exceso de NaOH, el pH es 10,30; y cuando el exceso es de 1 cm3, el pH es 11,29.
Se observa así que en las proximidades del punto de neutralización se produce un salto del pH (de unas 7 unidades), que puede ponerse de manifiesto con cualquier indicador ácido-base; por ejemplo, añadiendo unas gotas de disolución de tornasol. Antes del punto de neutralización, la disolución que se está valorando (ácida) tomará color rojo, que virará a azul, nada más pasarlo (disolución básica).
|
| Imagen 4 Elaboración propia |
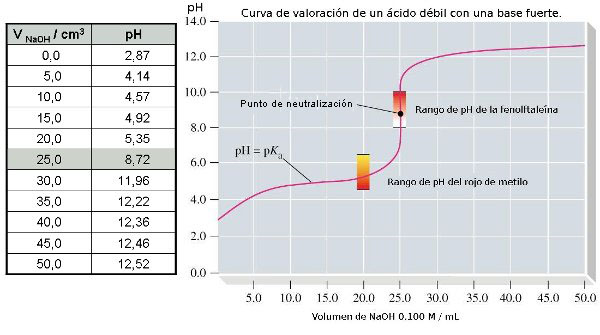
Cuando se valora un ácido débil (como ácido acético) con una base fuerte (NaOH), el salto de pH es menor y, por otra parte, en el punto de neutralización la disolución es ya básica (pH > 7), puesto que se hidroliza el ión acetato. Análogamente, cuando se valora una base débil (amoniaco) con un ácido fuerte (HCl), también es menor el salto de pH y, además, en este caso, la disolución es ácida (pH < 7) en el punto de neutralización, puesto que ahora se hidroliza el ión amonio.
¿Cuál es el indicador adecuado?
Hay que prestar atención al elegir el indicador apropiado, ya que su cambio de color debe producirse cuando se realice el salto de pH al llegar al punto de neutralización.
Para ello, hay que elegir un indicador cuya zona de viraje esté dento del salto de pH. Si te fijas en la primera imagen, verás que el azul de timol y el amarillo de alizarina no son adecuados para la valoración de ácido fuerte con base fuerte; a partir de la segunda, puedes deducir que el rojo de metilo no es adecuado, pero la fenolftaleína sí.
Para determinar el punto final de una valoración se puede usar un pHmetro: se deja de añadir disolución desde la bureta cuando se produce un salto de pH apreciable, y así no es necesario utilizar un indicador, tal y como puedes apreciar en la simulación siguiente.
Puedes comenzar añadiendo reactivo desde la bureta de mililitro en mililitro, y cerca del punto de neutralización, de 0,5 en 0,5 o de 0,1 en 0,1 mL, para apreciar mejor el momento en que se produce la neutralización. Fíjate en los cuatro casos que se proponen y en el indicador adecuado en cada caso.
|
|
| Simulación 4 Salvador Hurtado, Creative commons |
