2. El pH y la solubilidad
Si al disolverse parcialmente una sustancia poco soluble origina iones H3O+ o OH-, o bien reacciona químicamente para originarlos, al variar la acidez del medio también cambiará la solubilidad de la sustancia.
Los casos más importantes son la solubilidad de hidróxidos y la de sales que se hidrolizan. De esta forma se disuelven carbonatos, sulfuros, fosfatos, etc. En el caso de los carbonatos se desprende CO2, ya que el ácido carbónico, H2CO3, que se forma es inestable y se descompone.
Solubilidad de hidróxidos
Al añadir Fe(OH)3(s) a agua se establece el equilibrio Fe(OH)3(s) ↔ Fe3+(aq) + 3 OH-(aq).
¿Qué sucede al añadir disolución de una sustancia básica, por ejemplo NaOH, sólido o disuelto? Aumenta la [OH-], con lo que, de acuerdo con el principio de Le Chatelier, el equilibrio de solubilidad del Fe(OH)3 se desplaza a la izquierda, y disminuye su solubilidad.
¿Y qué sucederá al añadir una sustancia ácida, por ejemplo disolución de HCl? Aumenta la [H3O+] y disminuye la [OH-], con lo que, de acuerdo con el principio de Le Chatelier, el equilibrio de solubilidad del Fe(OH)3 se desplaza a la derecha, y aumenta su solubilidad.
Solubilidad de sales que se hidrolizan
Considera lo que sucede al añadir a agua una cierta cantidad de una sal cuyo anión se hidroliza en disolución, ya que proviene de un ácido débil y tiene tendencia a producirlo. Por ejemplo, el equilibrio establecido al añadir CdS(s) a agua:
CdS(s) ↔ Cd2+(aq) + S2-(aq)
Simultáneamente se establece el equilibrio en el que se hidroliza el ión sulfuro para producir ácido sulfhídrico.
S2-(aq) + H2O ↔ H2S(g) + 2 OH-(aq)
Al añadir una sustancia básica, por ejemplo disolución de NaOH, aumenta la [OH-] y el equilibrio de hidrólisis se desplaza a la izquierda de acuerdo con el principio de Le Chatelier, con lo que aumenta la [S2-], por lo que el equilibrio de solubilidad se desplaza a la izquierda y disminuye la solubilidad.
Al añadir una sustancia ácida, por ejemplo disolución de HCl, aumenta la [H3O+], con lo que disminuye la [OH-], el equilibrio de hidrólisis se desplaza a la derecha, lo que produce que disminuya la [S2-], por lo que el equilibrio de solubilidad se desplaza a la derecha y aumenta la solubilidad.
Solubilidad y pH
La solubilidad de los hidróxidos y de las sales que se hidrolizan aumenta al añadir sustancias ácidas y disminuye al añadir sustancias básicas.
Formación de estalactitas
En la imagen siguiente puedes ver las fases de producción de estalactitas por la acción del CO2 y el H2CO3 sobre suelos calizos.
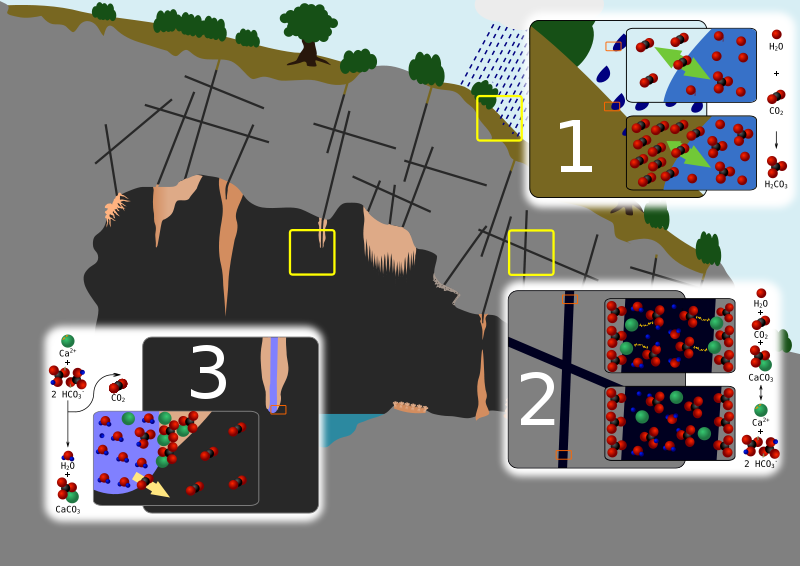 |
| Imagen 5 Chris, Creative commons |
