7.1 Fuerzas intermoleculares
Para explicar las propiedades de las sustancias iónicas se recurre a fuerzas electrostáticas entre iones o entre iones y electrones en las metálicas, así como a la compartición de electrones en las sustancias covalentes. Pero ¿y en las sustancias moleculares?
Para explicar por qué el agua se puede encontrar en estado sólido hay que justificar qué fuerzas mantienen unidas las moléculas de agua. Y los enlaces covalentes explican lo que pasa dentro de la molécula, pero no dicen nada de lo que sucede entre ellas.
Por tanto, necesariamente deben existir fuerzas entre las moléculas, llamadas fuerzas intermoleculares.
Tipos de fuerzas intermoleculares
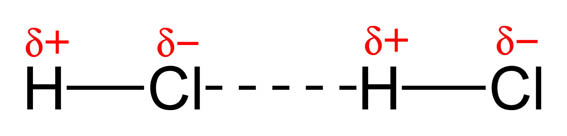
Si las moléculas son polares, se orientan entre sí debido a la separación de cargas, y más cuanto más polares son. Eso es lo que sucede entre moléculas de HCl: hay interacciones dipolares, como puedes ver en la imagen.
 |
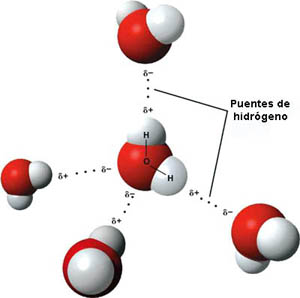 |
| Imagen 33 Benjah-bmm27, dominio público | Imagen 34, Michal Mañas, Creative commons |
En el caso del agua, esas interacciones son particularmente intensas, y se llaman puentes de hidrógeno. Se dan entre moléculas cuya parte positiva del dipolo es el H y la negativa es F, N u O. Son muy importantes para explicar las interacciones que se dan en procesos bioquímicos. En imagen puedes ver como se simula su formación entre moléculas de agua.
Por último, hay que explicar cómo hay sustancias cuyas moléculas no son polares y que, sin embargo, se encuentran en estado sólido a temperatura ambiente. Con ese fin se propone que hay un tipo de fuerzas llamadas dispersivas, que aumentan con la masa de la molécula, y que están relacionadas con la existencia de dipolos instantáneos cuando se acercan la moléculas. Estas fuerzas se dan entre todas las moléculas, sean polares o no.
Tipos de fuerzas intermoleculares
Dispersivas: existen siempre entre cualquier tipo de molécula, dependiendo de su masa.
Dipolares: se dan entre moléculas polares, y son más intensas al aumentar su polaridad. Un tipo particularmente intenso son los puentes de hidrógeno, que se producen si hay enlaces O-H o N-H.
| Compuesto | T ebullición (ºC) |
| metano | -162 |
| etano | -89 |
| propano | -42 |
| butano | 0 |
| pentano | 36 |
| hexano | 68 |
Fíjate en los datos de la tabla siguiente. Teniendo en cuenta que se trata de sustancias no polares, justifica la secuencia de valores de puntos de ebullición.