2.3 Electronegatividad
|
|
| Animación 5. Jesús Peñas Permiso uso educativo |
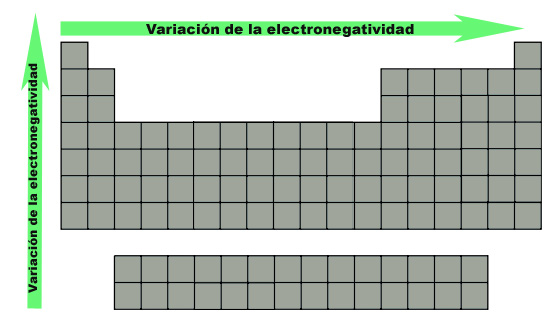
La electronegatividad es una propiedad periódica que varía de la siguiente forma:
En un grupo: al ir descendiendo dentro de un mismo grupo, el radio atómico aumenta y la energía de ionización disminuye, lo que indica que los electrones se ven menos atraídos y por lo tanto la electronegatividad disminuye de arriba abajo.
En un periodo: cuando nos desplazamos a través de un periodo disminuye el radio atómico y aumenta la energía de ionización, haciendo que sea cada vez más difícil extraer un electrón. En consecuencia la electronegatividad aumenta de izquierda a derecha.
En resumen, la variación de la electronegatividad se observa en la siguiente imagen, donde la flecha indica el aumento de la electronegatividad (recuerda que los gases nobles no la tienen definida):
 |
| Imagen 18. Elaboración propia |
Clasifica los siguientes elementos en orden decreciente de su electronegatividad:
Ba, Be, Sr, Mg, Ca