2.2 Energía de ionización
La energía de ionización de un elemento químico es la energía necesaria para arrancar el electrón más externo de la corteza de un átomo de este elemento en estado gaseoso, dando lugar a su catión aislado. Suele denotarse como EI. Para un elemento genérico X sería:
X(g) + EI → X+(g) + e-
En átomos polielectrónicas puede definirse la segunda, tercera, cuarta,... energías de ionización como las necesarias para arrancar un segundo, tercer, cuarto,... electrón más alejado del núcleo.
En la siguiente animación puedes observar cuál es el valor de la primera energía de ionización de los elementos de la tabla y cómo es su variación:
|
|
| Animación 4. Jesús Peñas Permiso uso educativo |
La energía de ionización es una propiedad periódica que varía de la siguiente forma:
- En un grupo: los átomos tienen la misma estructura electrónica en la capa más externa. Pero como la capa va siendo cada vez más grande, los electrones están más lejos del núcleo y menos atraídos, por lo que se pueden arrancar con mayor facilidad. El tamaño del átomo aumenta al hacerlo el número de capas electrónicas; también lo hace la atracción nuclear, al aumentar el número de protones en el núcleo, pero en menor medida debido al apantallamiento de las capas interiores, razón por la cual la energía de ionización disminuye al descender en un grupo.
- En un periodo: en este caso según hemos visto el radio atómico disminuye al avanzar en un periodo, al aumentar el número de protones con el número atómico. Por ello los electrones se ven atraídos con más fuerza y es necesaria mayor energía para arrancar el electrón más externo. En consecuencia, la energía de ionización aumenta al desplazarnos a lo largo de un periodo.
Una consecuencia de este comportamiento es el alto valor de la energía de ionización de los gases nobles, que es una de las razones por las que son inertes, así como de la gran reactividad de los metales alcalinos y alcalinotérreos (¡recuerda la historia inicial!).
En resumen, la variación del radio atómico referida a la posición en
la tabla periódica puede observarse en la siguiente imagen, donde la
flecha indica el aumento de la energía de ionización:
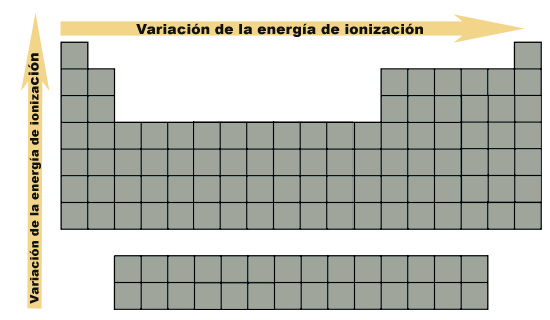 |
| Imagen 17. Elaboración propia |
La energía de ionización del magnesio (Mg) es mayor que la del calcio (Ca).
¿Qué significa esta afirmación? ¿Podrías explicar por qué ocurre así?¿En cuál de las siguientes series los elementos están ordenados por orden creciente de su energía de ionización?
Li > Be > C > N > O
| |
C > N > O > Be > Li
| |
O > N > C > Li > Be
| |
O > N > C > Be > Li
| |