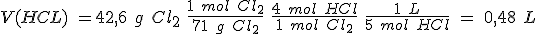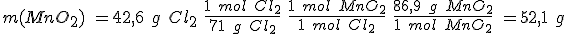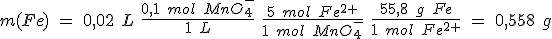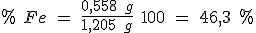5.1 Cálculos en las reacciones redox
Energética de las reacciones redox
Cuando se produce una reacción redox también hay intercambios energéticos apreciables, que pueden originar incrementos de temperatura muy notables, por lo que se puede hacer una análisis energético de estas reacciones.
|
|
| Vídeo 3 UEL, Uso educativo |
Observa en el vídeo la reacción entre iones cobre con cinc en polvo. Fíjate en cómo el sensor de temperatura detecta un aumento de más de 30 ºC.
a) Escribe la reacción que se produce.
b) ¿Es espontánea?
c) ¿Cómo es la variación de entalpía en el proceso?
d) Indica las transformaciones de energía que se han producido en la reacción.
e) ¿Por qué se añade el cinc pulverizado?
Cálculos estequiométricos
Al igual que ocurre con cualquier otro tipo de reacciones, con las reacciones de oxidación-reducción también puedes realizar cálculos estequiométricos después de ajustarlas. A continuación tienes dos ejercicios en los que tendrás que calcular masas, cantidades de sustancia, volúmenes de gases o volúmenes de disolución.
El cloro es un gas muy utilizado en la industria química, por ejemplo, como blanqueador de papel o para obtener artículos de limpieza. Se puede obtener según la reacción:
MnO2 (s) + HCl (aq) → MnCl2 (aq) + Cl2 (g) + H2O
Se quieren obtener 42,6 g de cloro y se dispone de ácido clorhídrico 5,0 M y de óxido de manganeso (IV).
a) Ajusta la reacción por el método del ion electrón.
b) Calcula el volumen de la disolución de ácido clorhídrico y la masa mínima de óxido de manganeso (IV) que se necesitan para obtener los 42,6 g de cloro.
A 1,205 g de un mineral de hierro se le añade ácido sulfúrico diluido, con lo cual todo el hierro que contiene el mineral se disuelve como hierro (II). Para oxidar este hierro (II) hasta hierro (III) se consumen 20 ml de disolución de permanganato 0,10 M.
a) Escribe y ajusta por el método del ión electrón la reacción de oxidación de hierro (II) a hierro (III), sabiendo que el permanganato se reduce hasta sal de manganeso (II).
b) Calcula el porcentaje de hierro en el mineral.