3. Oxidantes y reductores. Pares redox
Un oxidante es una especie química (átomo, molécula o ión) que produce la oxidación de otra, llamada reductor.
Ahora bien, para que una sustancia oxide a otra tiene que captar electrones, que provienen de esa otra sustancia, por lo que disminuirá su número de oxidación y por tanto, ella misma se reducirá. Y a la inversa, el reductor tiene que ceder electrones y, por tanto, se oxida. Las reacciones redox ocurren, pues, entre parejas de oxidación-reducción, llamadas pares conjugados de oxidación reducción o, simplemente, pares redox:
oxidante1 + reductor2 ↔ reductor1 + oxidante2
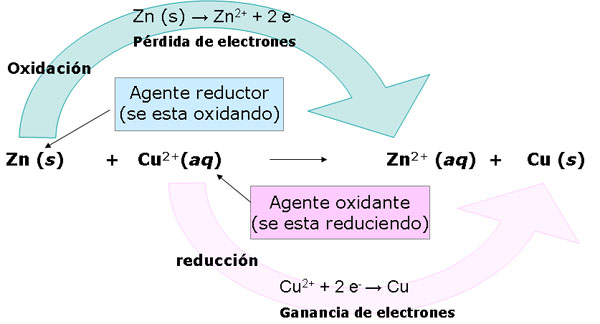 |
| Imagen 6 Elaboración propia |
Seguro que todo esto te recuerda a las reacciones ácido-base. El paralelismo entre los pares conjugados ácido-base (según la teoría de Brönsted-Lowry) y los pares redox se ve claramente en el cuadro siguiente:
| Ácido - base | Redox | |
| Transferencia de | protones | electrones |
| Donor | ácido | reductor |
| Aceptor | base | oxidante |
Oxidantes y reductores
Oxidante: sustancia que oxida a otra, por lo tanto se reduce y contiene un elemento cuyo número de oxidación disminuye.
Reductor: sustancia que reduce a otra, por lo tanto se oxida y contiene un elemento cuyo número de oxidación aumenta.
Como viste en las reacciones ácido-base, hay productos que se encuentran en casa y que nunca deben mezclarse, porque se produce una reacción en la que se forman productos muy peligrosos. ¡Recuerda el caso de la socorrista tóxica!
Esas reacciones son procesos redox. Por ejemplo, la reacción del amoniaco con el hipoclorito presente en la lejía produce un gas muy tóxico, la cloroamina, NH2Cl(g) :
NH3(g) + ClO-(aq) → NH2Cl(g) + OH-(aq)
Por otro lado, cuando el salfumán se mezcla con lejía, se produce cloro, un gas muy venenoso:
H+(aq) + Cl-(aq) + ClO-(aq) → Cl2(g) + H2O(l)
Identifica los pares redox en cada uno de los procesos, e indica en cada caso la variación producida en los números de oxidación.
 |
| Imagen 7 Elaboración propia |
El aluminio
Este metal tiene una característica muy particular. Observa la olla de aluminio de la imagen. Su superficie es metálica, brillante y dura. Pero es que lo que ves no es aluminio, sino óxido de aluminio, ya que el metal se oxida en contacto con el aire, formándose una película de un espesor muy pequeño. Esa capa protege al metal, evitando que se oxide totalmente, y le proporciona mayor resistencia, al ser un material más duro que el aluminio.
Si tienes oportunidad, raya una superficie de aluminio con una llave y verás que la raya es mucho más brillante (¡aparece el aluminio!), pero en muy poco tiempo toma el color del resto del objeto, al formarse la capa de óxido.
|
El oxidante cede electrones al reductor.
| |
|
En la oxidación, el reductor reduce al oxidante.
| |
|
En una reacción redox, el oxidante gana electrones del reductor, que a su vez se
reduce.
| |
|
Un oxidante se oxida al reducir al reductor.
|