2.1 Equilibrios de hidrólisis
Hidrólisis de un catión
En las sales de amonio, por ejemplo, el catión es el ion NH4+. Este ión es un ácido de Brönsted capaz de ceder un protón. La reacción de este ión con el agua (hidrólisis del ion amonio) produce, pues, iones hidronio:
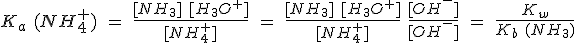
En general, cualquier catión cuya base conjugada sea débil tendrá, en mayor o menor medida, caracter ácido.
Si la base conjugada es fuerte no hay hidrólisis, ya que es más estable el catión que el hidróxido; es lo que sucede con Na+ y NaOH.
Hidrólisis de un anión
Al disolver KCl en agua, el anión liberado, ion Cl-, es la base conjugada del HCl. Por ser éste un ácido fuerte, el ión Cl- será una base muy débil y no aceptará protones del agua. Por tanto, el Cl- no se hidroliza para dar lugar a HCl. Los aniones de todos los ácidos fuertes (Cl-, Br-, I-, NO3-, ClO4-) se comportan de un modo similar.
Sin embargo, si disuelves CH3COONa, el anión liberado, el ion CH3COO-, es la base conjugada del CH3COOH. Dado que éste es un ácido débil, el ión CH3COO- tiene cierta tendencia a captar un protón, incluso de un ácido tan débil como el agua, estableciéndose el equilibrio:
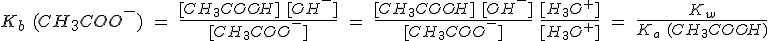
Los iones OH- producidos hacen que la disolución sea básica. En general, todo anión de un ácido débil será más o menos básico.
Un anión cuyo ácido conjugado sea débil se hidroliza dando iones OH-. Un anión cuyo ácido conjugado sea fuerte no se hidroliza.
Hay cuatro tipos de sales, dependiendo de si el ácido o la base que las han producido por neutralización son fuertes o débiles.
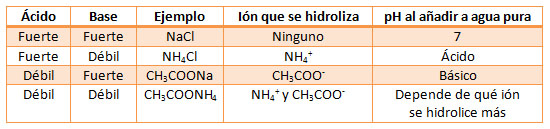
Los datos de pH obtenidos en la simulación anterior permiten obtener conclusiones interesantes.
a) ¿Por que una disolución de NaHCO3 se puede utilizar como antiácido estomacal?
b) El pH de una disolución de CH3COONH4 es neutro, siendo que los dos iones de la sal se hidrolizan. ¿Cuál es la razón?
Indica el valor aproximado del pH final al añadir:
a) 1 gramo de Na2SO4 a 500 mL de disolución de pH=5.
b) 1 g de NH4Cl a 500 mL de disolución de pH=13.