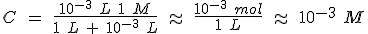3. Disoluciones reguladoras del pH
En general, el pH de las disoluciones varía bruscamente al añadir ácidos o bases. Incluso añadiendo cantidades pequeñas a disoluciones de pH intermedio, las variaciones pueden ser muy apreciables, de varias unidades de pH.
También cambia el pH al diluir, pero en este caso el efecto es mucho menor: al aumentar el volumen diez veces, la concentración se reduce a la décima parte, pero el logaritmo disminuye solamente una unidad, y la variación de pH es 1.
 |
| Simulación 3 Chang, Uso educativo |
Sin embargo, hay disoluciones que se caracterizan porque su pH permanece prácticamente invariable tanto por dilución como por adición de cantidades moderadas de ácido o de base.
Estas disoluciones se llaman reguladoras, amortiguadoras o tampon.
Una disolución reguladora debe contener una concentración relativamente grande de un ácido para reaccionar con los iones OH- que se le añadan, y también debe contener una concentración suficiente de una base para neutralizar los iones H3O+ que se le agreguen. Además, los componentes ácido y básico del amortiguador no deben consumirse entre sí en una reacción de neutralización. Estos requisitos se satisfacen con un par ácido-base conjugados.
En la práctica se preparan mezclando, en concentraciones elevadas, un ácido débil (o una base débil) y una de sus sales muy disociada, que contenga su base conjugada, (o su ácido conjugado): ácido acético + acetato de sodio, amoniaco + cloruro de amonio, ácido cianhídrico + cianuro de potasio, etc.
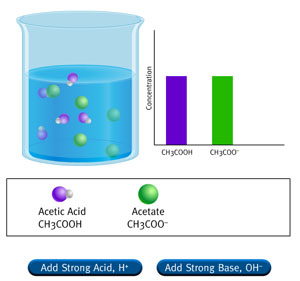
Fíjate en la simulación y verás que al añadir H+ o OH- el acetato se transforma en ácido acético o al revés, de manera que desaparecen las cantidades añadidas, que deben ser pequeñas frente a las que había inicialmente de ácido o de sal.
 |
| Imagen 5 Iaorana Uso educativo |
La utilización de disoluciones amortiguadoras para obtener medios tamponados es muy importante, ya que hay multitud de reacciones químicas que únicamente se producen en un estrecho intervalo de pH. Usando disoluciones amortiguadoras se pueden tamponar medios prácticamente en todo el intervalo de pH.
Las disoluciones amortiguadoras son muy importantes en Bioquímica, ya que la mayor parte de los líquidos de los organismos tienen un pH característico, al estar regulados por varios sistemas. Por ejemplo, el pH de la sangre es 7,35 y sus variaciones normales son inferiores a 0,1 unidades, siendo fatal un cambio de pH de 0,4 unidades, la saliva tiene un pH de 6,9; la bilis 7,7; el jugo pancreático 8,3; etc.