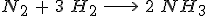2.4 Utilizando las entalpías de enlace
Se llama energía de enlace a la cantidad de energía necesaria para romper un enlace en un mol de sustancia. Se suele utlizar el término entalpía de enlace, ya que las reacciones se producen habitualmente a presión constante. Las sustancias deben estar en estado gaseoso, para que la energía comunicada se invierta en romper enlaces y no en cambios de estado.
 |
 |
| Imagen 15 Elaboración propia | Imagen 16 Elaboración propia |
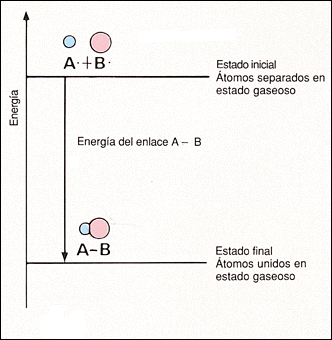
Fíjate en la imagen de la izquierda: la energía química de los átomos A y B unidos es menor que cuando están separados. La energía de enlace es precisamente la disminución de energía observada, pues será el valor que habrá que comunicar para que se separen cuando están unidos.
Se trata de valores promedio, ya que la energía de un enlace C-C no es la misma en el etano que en el butano, ya que en un caso solamente hay hidrógenos unidos a los átomos de carbono enlazados y en el otro hay grupos más complejos (metilo, etilo, etc). En las tablas de datos se indica la media de los valores medidos experimentalmente. Por esa razón, a veces hay diferencias apreciables entre los resultados obtenidos utilizando entalpías de formación y los obtenidos con energías de enlace, que son aproximados. Estas diferencias son más notables cuanto más compleja es la reacción.
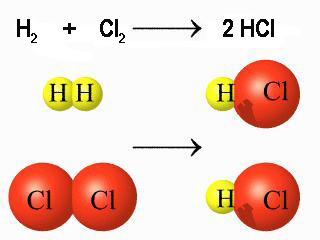
Una vez tabuladas, las energías de enlace se utilizan para calcular entalpías de reacción. Para ello, es necesario detallar qué enlaces se rompen y se forman en la reacción, sumando las energía de enlace de los enlaces rotos y restando las de los enlaces formados. Previamente, es necesario detallar el mecanismo de reacción, es decir, los enlaces que se deben romper para que los reactivos se puedan transformar en productos, así como los enlaces formados en los productos.
ΔH = ∑ nR E (enlaces rotos) - ∑ nP E (enlaces formados)
donde nR y nP son el número de enlaces de cada tipo rotos o formados en el proceso.
Utiliza el simulador para determinar entalpías de reacción utilizando energía de enlace. Selecciona la reacción, detalla su mecanismo, busca los datos que necesites en la tabla de valores y determina el valor resultante.
Simulación 4. Elaboración propia