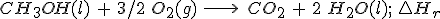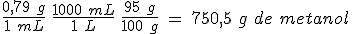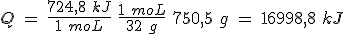2.3 A partir de las entalpías de formación
¿Cómo puedes calcular entalpías de reacción utilizando datos de entalpías de formación? No tienes más que escribir la reacción, ajustarla, buscar los datos que necesites en la tabla de datos (que conviene que imprimas) y utilizar la expresión siguiente:
Es decir, sumar el contenido energético de los productos y quitarle la suma del contenido energético de los reactivos, teniendo en cuenta la cantidad de sustancia que interviene de cada una de las sustancias.
El simulador que tienes a continuación vas a utilizarlo para trabajar con entalpías, H. En el tema siguiente utilizarás las otras dos magnitudes, entropía S y energía libre G, que también aparecen en la tabla de datos.
Tienes cuatro ejemplos de cálculo resueltos (pulsa calcular para ver cómo se resuelven), pero puedes resolver otros muchos: solamente tienes que seleccionar el tipo de reacción y la sustancia, buscando los datos en la tabla de valores del propio simulador.
Simulación 3. Elaboración propia
a) Determina la entalpía de combustión del metanol (CH3OH). Utiliza el simulador, eligiendo Reacción de combustión del metanol. Resuelve el problema en papel y comprueba el resultado, que te dará el simulador al pulsar Calcular.
b) Calcula el calor intercambiado al quemar un litro de alcohol de quemar, que tiene una densidad de 0,79 g/mL y un 95% de alcohol en masa.