6.1. Ciclo de Carnot
- Se suministra al motor energía en forma de calor a temperatura elevada.
- La acción del calor permite realizar un trabajo mecánico al motor.
- El motor cede calor al foco de temperatura inferior.
El ciclo de Carnot es un ciclo teórico y reversible, su limitación es la capacidad que posee un sistema para convertir en calor el trabajo, se utiliza en las máquinas que usan vapor o una mezcla de combustible con aire u oxígeno.
 |
| Imagen 14. periodni. Copyright |
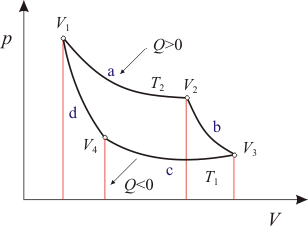
El ciclo se divide en cuatro etapas, cada una de las cuales se corresponde con una transformación termodinámica básica:
- Etapa A) Expansión isotérmica
En el gráfico es el paso del estado 1 al estado 2. Es un proceso isotermo y por ser un gas perfecto eso hace que la temperatura se mantenga constante T1.
El gas se encuentra en un estado de equilibrio inicial representado por p1, V1, T1, en el interior del cilindro. Se produce una expansión isotérmica entre 1 y 2, hasta alcanzar los valores p2, V2, T1, el sistema realiza un trabajo W1 positivo (aumenta el volumen, luego es un trabajo hecho por el sistema, trabajo positivo), comunicando energía al entorno, por otro lado como la variación de energía interna ha de ser cero, toma un calor del entorno equivalente Q1:
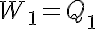
- Etapa B) Expansión adiabática
Se parte del punto 2 y se llega al estado 3.
Por ser un proceso adiabático no hay transferencia de calor, el gas debe realizar un trabajo, elevando el émbolo, para lo que el cilindro debe estar aislado térmicamente, alcanzándose los valores p3, V3, T2.
- Etapa C) Compresión isotérmica
Entre los estados 3 y 4, hasta alcanzar los valores p4, V4, T2, siendo el trabajo realizado por el pistón. En este caso es un trabajo de compresión (negativo), se recibe energía del entorno en forma de trabajo y se cede una energía equivalente en forma de calor:
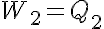
- Etapa D) Compresión adiabática
Entre los estados 4 y 1 cerrándose el ciclo.
Se alcanzan de nuevo los valores p1, V1, T1 sin transferencia de calor con el exterior.
Consideramos ahora el efecto global del ciclo.
- El trabajo neto W realizado durante el ciclo por el sistema será el representado por la superficie encerrada en el trayecto 1-2-3-4-1.
- La cantidad neta de energía calorífica recibida por el sistema será la diferencia entre Q2 y Q1.
Para calcular el rendimiento de un ciclo de Carnot se emplea la misma expresión mencionada anteriormente:
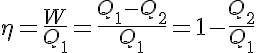
En la práctica es mucho más difícil obtener los valores de los calores trasegados que los valores de la temperatura (en grados Kelvin) de los dos focos, que se conocen por la lectura de un termómetro, y se puede considerar que la transmisión de calor es proporcional a las temperaturas de ambos focos sin que se cometa un error apreciable (recuerda que son gases perfectos y que la variación de energía interna es fución exclusiva de la variación de temperatura) por lo que se puede escribir:
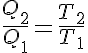
Y por lo tanto se puede expresar el rendimiento como:
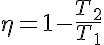
El rendimiento de este tipo de máquinas será mayor cuanto mayor sea la diferencia entre las temperaturas del foco caliente T1 y el foco frío T2.
Existen otros ciclos termodinámicos que también poseen el rendimiento máximo aunque se utilizan mucho menos que el de Carnot.
Determinar:
a) El rendimiento de la máquina térmica.
b) El máximo rendimiento que podría llegar a tener esa máquina térmica.
c) El calor cedido a la fuente fría.
Una máquina térmica absorbe 900 J de un foco caliente que se encuentra a 177ºC, presentando una eficiencia del 40%.
Determina:
a) Calor cedido al foco frío
b) Temperatura a que se encuentra el foco frío.
Un gas ideal diatómico (cv=5/2 R) se encuentra inicialmente a una temperatura T1=27ºC, una presión p1=105 Pa y ocupa un volumen V1=0.4 m3. El gas se expande adiabáticamente hasta ocupar un volumen V2=1,2 m3. Posteriormente se comprime isotérmicamente hasta que su volumen es otra vez V1 y por último vuelve a su estado inicial mediante una transformación isócora. Todas las transformaciones son reversibles.
a) Dibuja el ciclo en un diagrama p-V. Calcula el número de
moles del gas y la presión y la temperatura después de la expansión
adiabática.
b) Calcula la variación de energía interna, el trabajo y el calor en cada transformación.
Se pide:
a) Dibuja el ciclo en un diagrama p-V especificando las transformaciones que lo componen. Calcula la eficiencia.
b) Calcula el calor intercambiado en cada etapa y la relación entre los volúmenes en la compresión isoterma.
c) Sabiendo que después de la expansión isoterma el volumen del gas es V3= 0.5 m3, calcula la presión y el volumen después de la compresión adiabática.