5. Transformaciones termodinámicas
En este punto estudiaremos transformaciones termodinámicas que actúan sobre los llamados gases perfectos.
Un gas perfecto es aquel cuyo ecuación de estado tiene la forma:
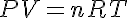
Donde:
- P es la presión del sistema (Pa)
- V el volumen (m3)
- n el número de moles gaseosos contenidos en el sistema
- T la temperatura (K)
- R la constante de los gases perfectos, cuyo valor en las unidades anteriores es 0,082 Pa.m3/K.mol (en unidades SI es 8.314 J/mol.K)
Transformación isócora. Transformación termodinámica que tiene lugar a volumen constante.
Un ejemplo de este tipo de transformaciones sería el proceso de calentamiento de los gases contenidos en un recipiente rígido y herméticamente cerrado.
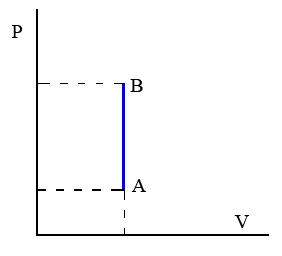 |
| Imagen 8. Recurso propio. |
Por ser constante el volumen, el trabajo en estos procesos es cero.
En este tipo de transformaciones se mantiene constante el volumen, pero además hay que tener en cuenta que:
- Si no hay reacción química también se mantiene constante el número de moles.
- Por otro lado R es una constante.
Por lo tanto puedo despejar en la ecuación de los gases perfectos y obtener:
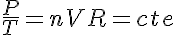
Si consideramos un instante incial 1 y un instante final 2:
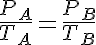
Ordenando términos:
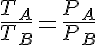
Además también tenemos que:
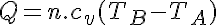
Donde cv es el calor específico a volumen constante.
Transformaciones isóbara: Transformación termodinámica realizada a presión constante.
Un ejemplo de este tipo de transformaciones sería el proceso de calentamiento de los gases contenidos en un globo herméticamente cerrado.
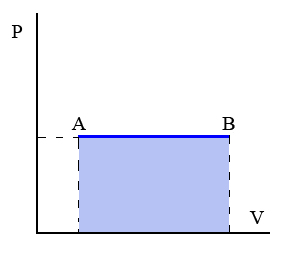 |
| Imagen 9. Recurso propio. |
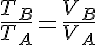
Además tenemos que:
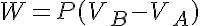
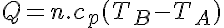
Donde cp es el calor específico a presión constante.
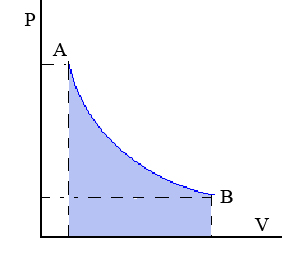
Transformación isoterma: Transformación termodinámica realizada a temperatura constante.
La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas.
 |
| Imagen 10. Recurso propio. |
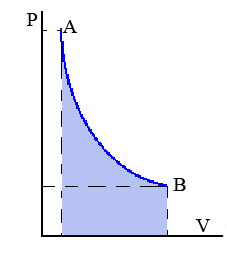
En el diagrama p-v se obtiene una hipérbola como en la figura. Por ello podemos escribir:
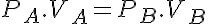
Además tenemos que el trabajo es el área bajo la curva:
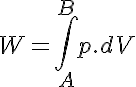
Por otro lado en los gases perfectos la energía interna sólo es función de la temperatura. Al ser esta constante en los procesos isotérmos se obtiene:
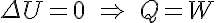
Transformación adiabática: Es la que tiene lugar sin intercambio de calor.
Un ejemplo de transformación de este tipo sería la compresión de un gas contenido en un cilindro en la que se varía el volumen a través de un émbolo, estando el sistema cerrado y aislado térmicamente del exterior.
 |
| Imagen 11. Recurso propio. |
En este tipo de transformaciones el diagrama p-V toma la forma de una hipérbola como en la figura. La ecuación que describe estos procesos es:
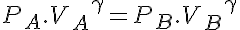
Donde γ es el coeficiente adiabático del gas (en el caso del aire γ=1,4).
Además tenemos que:
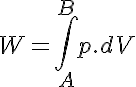
Por otro lado como Q=0
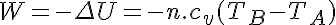
Donde cv es el calor específico a volumen constante.
La transformación adiabática siempre presenta mayor pendiente que la isoterma.
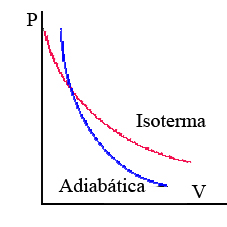 |
| Imagen 12. Recurso propio. |
En una transformación
termodinámica se comprime un gas isobáricamente a una presión de 0,8 atm desde
un volumen de 9 dm3 hasta 2dm3, mientras transcurre el
proceso el gas cede al ambiente una energía calorífica de 400j.
Determinar: Trabajo que realiza
el gas durante la transformación y el incremento de energía interna que
experimenta el gas.
Determinar: el trabajo realizado por el gas durante el proceso y el calor total cedido al sistema.
Determinar: El volumen final del gas. El trabajo realizado por el gas durante el proceso, y el calor que se transfiere.
Determine: La modificación de energía interna del gas, y su temperatura el final del proceso.