3.1 El pH de las disoluciones reguladoras
Vas a tomar como ejemplo el tampon ácido acético-acetato. La concentración del ácido es ca y la de la sal, acetato de sodio, es cs. Hay que considerar las reacciones de disociación del ácido acético y de disolución del acetato de sodio (ésta se produce totalmente al ser una sal soluble). Se supone despreciable el equilibrio del agua.

Debido a que la sal produce iones acetato, el equilibrio de ionización del ácido se desplaza a la
izquierda, con lo que el ácido acético se ioniza todavía menos que en
agua pura por efecto de ión común.
Para calcular el pH de una disolución tampon hay que considerar que la concentración de acetato en el equilibrio se debe a la disociación de la sal y casi nada a la del ácido, mientras que la concentración de acético es prácticamente la inicial del ácido, por lo que:
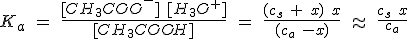
Es importante que te des cuenta de que debes resolver el equilibrio exactamente igual que en cualquier otro caso. Fíjate en que si ca y cs son iguales, entonces x=[H3O+]=Ka, independientemente de los valores de ca y cs.
Aunque no es estrictamente necesaria, se suele utilizar la expresión siguiente:
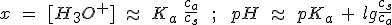
Utilizando disoluciones amortiguadoras
La simulación siguiente te va a permitir preparar disoluciones amortiguadoras y observar el efecto que produce sobre su pH la adición de ácidos y bases.
|
|
| Simulación 4 Greenbowe, Uso educativo |
Selecciona la mezcla de ácido y de sal, fija sus concentraciones con las barras deslizadoras y mide su pH insertando los sensores en la disolución resultante. En la segunda parte del simulador observarás el efecto que tiene sobre el pH de la disolución la adición de una determinada cantidad de sustancia de ácido o de base.
Añadiendo ácidos o bases a mezclas amortiguadoras
Utiliza el simulador para ver cuánto varía el pH de una disolución amortiguadora al añadir ácido o base. Selecciona el tampon acético-acetato (HC2H3O2 + NaC2H3O2) y concentraciones 10 10-2 M (0,1 mol/L). Entrando en la parte II, añade 10-3 mol de HCl, y observa cuánto varía el pH. Vuelve a hacer lo mismo añadiendo NaOH.
Puedes variar de mezcla amortiguadora, cambiar las concentraciones, añadir cantidades diferentes de base, etc, observando el efecto producido en cada caso: la variación va a ser mucho menor que si la adición fuese a un medio no tamponado.
|
3,00
| |
|
Un poco menos de 5,00
| |
|
Un poco más de 5,00
| |
|
7,00
|
|
Cloruro de sodio y ácido acético.
| |
|
NaNO3 y NH3.
| |
|
Amoniaco y cloruro de amonio.
| |
|
Na2S y H2S.
|