2. La constante de equilibrio
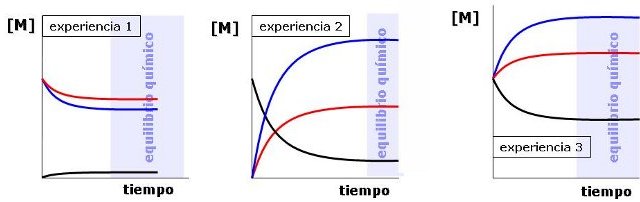
Ahora vas a analizar una tabla de datos correspondiente a la síntesis del metanol. Dispones de los datos de tres experiencias, en las que se mezclan diferentes cantidades de CO, H2 e incluso CH3OH, de forma que cuando se alcanza la situación de equilibrio en cada una de ellas las concentraciones son diferentes.
Debajo tienes las gráficas de evolución de las concentraciones en función del tiempo en cada caso.
CO(g) + 2 H2(g) ↔ CH3OH(g)
| |
concentraciones iniciales |
concentraciones en el equilibrio |
||||
| Experiencia | [CO] | [H2] | [CH3OH] | [CO]eq | [H2]eq | [CH3OH]eq |
| 1 | 0,100 | 0,100 | 0,000 | 0,0911 | 0,0822 | 0,0089 |
| 2 | 0,000 | 0,000 | 0,100 | 0,0753 | 0,1510 | 0,0247 |
| 3 | 0,100 | 0,100 | 0,100 | 0,1380 | 0,1760 | 0,0620 |
 |
| Imagen 5 Elaboración propia |
Seguramente no vas a poder extraer ninguna conclusión con los valores de esas concentraciones. Para lograrlo, vas a hacer un cálculo para cada una de las experiencias en el estado de equilibrio: divide la concentración de metanol por la de CO y por la de H2 al cuadrado, anotando los resultados obtenidos. Fíjate en que los valores obtenidos son muy aproximadamente iguales, independientemente de cuáles sean las condiciones iniciales. Por tanto, puedes afirmar que:
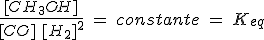
¿Cuál es la razón de este resultado? La cinética da la respuesta:
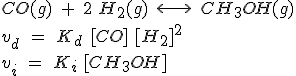
Cuando se alcanza el equilibrio, la expresión es:
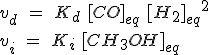
Igualando las velocidades y despejando como has visto antes:
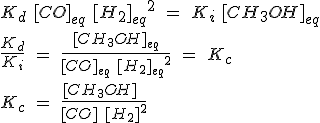
Como se indican las concentraciones de las sustancias, la constante de equilibrio se llama Kc, de concentraciones. Evidentemente, en la expresión intervienen las concentraciones en el equilibrio, y habitualmente no se indica (por esa razón ha desaparecido el subíndice eq, de equilibrio).