2.2 Constante de equilibrio y grado de reacción
Observa los datos de la tabla siguiente, correspondientes a tres sistemas que tienen la misma estequiometría, pero constantes de equilibrio muy diferentes. Son particularmente significativos los casos del HCl y del NO, ya que su síntesis se realiza a la misma temperatura.
| H2(g) + Cl2(g) ↔ 2 HCl(g) | Kc = 2,5 1033 a 298 K |
La reacción está muy desplazada a la derecha (en realidad se puede sustituir el símbolo ↔ por →). |
| H2(g) + I2(g) ↔ 2 HI(g) | Kc = 55,0 a 698 K |
Se trata de un verdadero equilibrio (hay concentraciones apreciables de reactivos y productos). |
| N2(g) + O2(g) ↔ 2 NO (g) | Kc = 5,3 10–31
a 298 K |
La reacción está muy desplazada a la izquierda, es decir, apenas se forman productos. |
En la síntesis del HCl, la constante es tan grande que el grado de reacción, es decir, el porcentaje de reactivos que se ha transformado en productos debe ser prácticamente del 100%: piensa en que en el numerador está la cantidad de productos formados y en el denominador las de reactivos que no han reaccionado, ¡y el cociente debe ser de 1033!
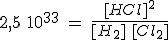
La situación contraria se da en la síntesis del NO, que tendrá un grado de reacción prácticamente nulo, mientras que la descomposicón del NO se realizará totalmente.
Evidentemente, el primer caso será muy espontáneo, por lo que ΔGº será muy negativo, y en el segundo ΔGº será muy positivo.
¿Y qué sucede en la síntesis del HI? En el equilibrio hay cantidades del mismo orden de reactivos y productos, por lo que el grado de reacción será intermedio. Ahora es el momento de saber cómo se calcula la composición de un sistema que se encuentra en equilibrio y en el que hay cantidades apreciables de todas las sustancias que intervienen.
Keq y α
Cuanto mayor sea la constante de equilibrio, más grande es el grado de reacción, que es del 100% si la constante es suficientemente grande.
 |
| Imagen 6 Elaboración propia |
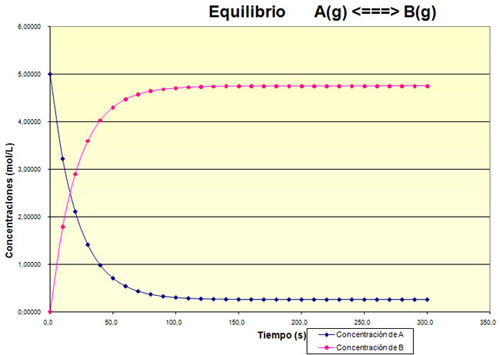
Observa la gráfica siguiente, que muestra la evolución de un sistema hasta alcanzar el equilibrio.
a) ¿Cómo crees que es el valor de la Kc, grande o pequeño?
b) Haz una estimación del grado de reacción.