2.1 Ley de acción de masas
Para una reacción cualquiera, se puede escribir una expresión general para la constante de equilibrio, en la que las concentraciones de las diferentes sustancias se refieren a la situación de equilibrio:
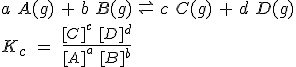
Como puedes ver, en el numerador se escribe el producto de las concentraciones de los productos elevados a sus coeficientes estequionétricos, y lo mismo en el denominador, pero referido a los reactivos. Esta expresión se conoce como ley de acción de masas.
La constante de equilibrio tiene un valor concreto para cada reacción, y varía solamente con la temperatura, ya que con ésta varían de forma diferente las constante de velocidad Kd y Ki.
Tipos de constantes de equilibrio
Para sistemas en disolución, se utiliza la Kc, como verás al estudiar los equilibrios de solubilidad o los procesos ácido-base. Pero si se trata de sistemas gaseosos, se suele usar una constante de equilibrio, llamada Kp, en la que se indican las presiones parciales de cada gas (la que produciría un gas dado si estuviese solo en el recipiente).
Para la reacción general anterior, la expresión sería:
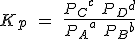
Relación entre Kc y Kp
Siguiendo con el sistema general anterior, y utilizando la ecuación de los gases, PV=nRT, en el gas A obtienes que:
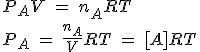
Para cada gas puedes obtener una ecuación similar. Ahora hay que sustituir cada presión parcial en la expresión de Kp y operar adecuadamente:
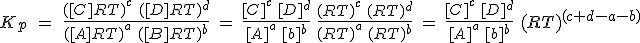
Si te fijas, te darás cuenta de que la primera parte de la expresión resultante es precisamente Kc. Además, el exponente de la segunda parte se suele escribir como Δn, y es la variación estequiométrica de la cantidad de sustancia de gas (suma de los coeficientes de sustancias gaseosas en productos menos los de los reactivos). En resumen, la expresión definitiva es:
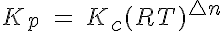
La constante de equilibrio no tiene unidades
Las constantes de equilibrio Kc y Kp sólo serían realmente constantes si se tratase de reacciones entre gases perfectos o en disoluciones ideales. En otro caso, la verdadera constante de equilibrio, llamada a veces constante termodinámica de equilibrio, hay que expresarla utilizando las llamadas actividades y se representa por Ka. La actividad de una sustancia puede considerarse como una especie de "concentración efectiva" o bien de "presión parcial efectiva", y es una magnitud que no tiene dimensiones. Por ello, la constante de equilibrio Ka es también adimensional, es decir, es un número sin dimensiones.
Este mismo criterio suele seguirse al dar los valores numéricos sin
dimensiones de Kc o de Kp. Sin embargo, se debe señalar entre
paréntesis las unidades en que se han medido las concentraciones o
presiones (estado de referencia), ya que, por ejemplo, el valor de Kp
puede ser distinto según que el estado de referencia de presiones sea
atmósferas o pascales o milímetros de Hg. El estado de referencia más
habitual es mol/litro para Kc y atm para Kp.
Constantes de equilibrio y ecuaciones de reacción
Cuando se multiplican los coeficientes estequiométricos de una reacción para obtener otra, la constante de equilibrio se eleva a la potencia correspondiente. La reacción 1 es el doble de la reacción 2, pero su constante es el cuadrado.
| 1) 2 N2O(g) + O2(g) ↔ 4 NO (g) | 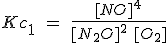 |
| 2) N2O(g) + 1/2 O2(g) ↔ 2
NO (g)
|
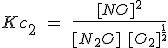 |
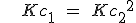 |
La relación es muy sencilla entre reacciones inversas, ya que como reactivos y productos invierten su posición, las constantes también son inversas una de la otra.
|
Menos de 155.
| |
|
Justo 155.
| |
|
Más de 155.
| |
|
Cero.
|