4. Catalizadores
 |
| Imagen 13 Elaboración propia |
Los catalizadores son sustancias que modifican la velocidad de una reacción química sin cambiar el producto final de la misma. A veces la luz o un campo eléctrico externo realizan también una labor catalizadora.
Habitualmente los catalizadores se recogen al final de la reacción sin que hayan cambiado, por lo que se necesitan cantidades muy pequeñas, pero con el tiempo experimentan un proceso de desgaste o incluso "envenenamiento" que les hace inservibles, sobre todo cuando trabajan a alta temperatura, ya que se volatilizan lentamente.
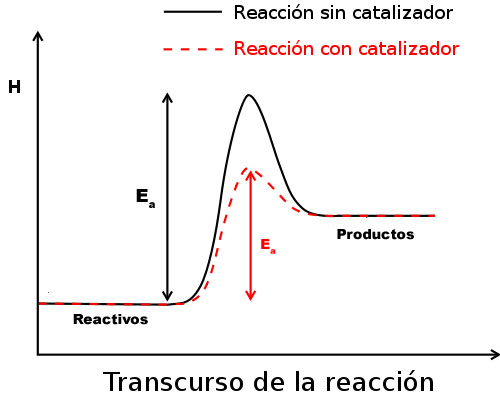
Un catalizador no puede provocar una reacción que no se pueda realizar por sí misma. Prácticamente hay un catalizador para cada reacción: son específicos de cada una, haciendo que la energía de activación sea menor.
La forma de actuar los catalizadores consiste en cambiar el mecanismo de la reacción, proporcionando un camino más simple, por lo que el tiempo de la reacción es menor. Toman parte activa en la reacción, formando compuestos intermedios que se descomponen rápidamente regenerando el catalizador, por lo que éste no se consume. De esta forma, el catalizador cambia el mecanismo de la reacción y hace que ésta transcurra por un camino diferente de menor energía de activación.
Los catalizadores que ralentizan las reacciones, aumentando la altura de la barrera de energía, se llaman inhibidores.
Características de los catalizadores
- Los catalizadores aparecen químicamente inalterados al final de la reacción.
- Una pequeña cantidad de catalizador es suficiente para producir una reacción considerable
- Los catalizadores no inician la reacción: sólo aceleran una reacción que se producía lentamente, aumentando la velocidad de reacción de 10 a 1012 veces.
Lo que cambia y lo que no cambia en la catálisis
Los catalizadores afectan a la cinética de la reacción pero no a su termodinámica: cambian la constante de velocidad y la energía de activación, pero no la entalpía ni la entalpía libre de reacción (ΔH y ΔG), ya que son funciones de estado.
Simulación 3. Elaboración propia
Autocatálisis
Consiste en la catálisis de una reacción por alguno de sus productos, de manera que la velocidad aumenta con la formación de producto. En realidad, los compuestos autocatalíticos no son catalizadores en sentido estricto, ya que su estructura química resulta alterada durante el proceso.
Por ejemplo, en la reacción del ácido oxálico con permanganato de potasio en medio ácido se produce ión Mn2+, que tiene acción autocatalítica.
|
Facilitar el contacto entre los reactivos.
| |
|
Disminuir la energía de activación.
| |
|
Aumentar la temperatura de la mezcla.
|