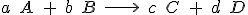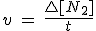1. La velocidad de las reacciones
Concepto de velocidad de reacción
Con el transcurso del tiempo, en una reacción química los reactivos se van transformando en productos. ¿Cómo se mide la rapidez de esta transformación? Para ello se utiliza el término de velocidad de reacción, cuyo significado es análogo al de cualquier otro tipo de velocidad.
Observa la tabla siguiente. ¿Eres capaz de comparar los conceptos que has utilizado en el estudio del movimiento en 1º de Bachillerato con los de la cinética química?
| Cinética química | |
| Estudia |
Los cambios en las concentraciones de reactivos y productos de una reacción química
|
| Velocidad media | 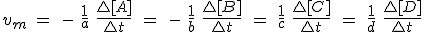 |
| Velocidad | 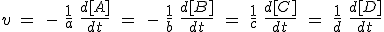 |
| Unidades | mol L-1 s-1 |
| Ecuación de velocidad | 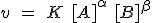 |
La velocidad de reacción representa la cantidad de uno de los reactivos
que desaparece por unidad de tiempo, o bien la cantidad de uno de los
productos que se forman por unidad de tiempo. En lugar de cantidad de
sustancia (en moles), se utilizan casi siempre concentraciones,
expresadas normalmente en mol L-1. Como unidad de tiempo se emplea generalmente el segundo. Por tanto, la velocidad de reacción se expresa en mol L-1 s-1.
¿Es constante la velocidad de reacción?
La velocidad de las reacciones químicas varía bastante con el tiempo, disminuyendo conforme se van consumiendo los reactivos. Esto hace que sea necesario utilizar el concepto de velocidad instantánea de la reacción para un tiempo dado, t, que se define como la derivada de la concentración (de un reactivo o de un producto) con respecto al tiempo en el momento considerado (la variación de concentración en un tiempo tan pequeño que tiende a cero). No te preocupes, porque no vas a necesitar el cálculo diferencial, pero debes ser consciente de la necesidad de tener conocimientos matemáticos sólidos para poder profundizar en los conocimientos científicos.
Fíjate en una reacción concreta, por ejemplo, en la de formación del amoniaco, según la reacción:
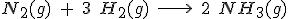
Si en un recipiente introduces nitrógeno e hidrógeno, es evidente que sus concentraciones disminuirán con el tiempo, mientras que la de amoniaco aumentará. Pero como por cada mol de N2 se consumen tres de H2, la velocidad de desaparición de H2 será tres veces mayor que la del N2. Por último, como por cada mol de N2 se forman dos moles de NH3, la velocidad de formación de NH3 será doble que la desaparición del N2.
Observa el detalle de que las velocidades de desaparición de los reactivos son negativas, y por eso se les añade el signo menos, para que todas sean positivas.
|
0,1 mol L-1 s-1
| |
|
0,2 mol L-1 s-1
| |
|
0,3 mol L-1 s-1
| |
|
0,4 mol L-1 s-1
|