3. Factores de los que depende la velocidad de reacción
Como la velocidad de una reacción depende del número de choques eficaces de las moléculas reaccionantes, para hacerla más rápida hay que aumentar ese número, que es función de:
- El número de choques totales, que depende de las concentraciones de los reactivos y de su estado físico.
- La eficacia de los choques, que depende principalmente del número de moléculas con energía cinética suficiente para superar la barrera de energía. Al aumentar la energía de las moléculas se favorece que los choques sean eficaces, lo que sucede al aumentar la temperatura.
- La energía de activación, que marca el nivel energético mínimo para que los choques sean eficaces; depende de la estructura molecular del complejo activado, es decir, de la naturaleza de los reactivos. Esta energía de activación se puede modificar mediante el uso de catalizadores.
- Naturaleza de los reactivos.
- Concentración.
- Estado físico de los reactivos.
- Temperatura.
- Catalizadores.
Concentración y estado físico de los reactivos.
De acuerdo con la teoría de las colisiones, para que se produzca una reacción química tienen que chocar entre sí las moléculas reaccionantes. Ahora bien, según la teoría cinética, el número de choques es proporcional a la concentración de cada uno de los reactivos. Por tanto, la velocidad de reacción será proporcional a la concentración de cada uno de los reactivos.
En las reacciones elementales, la velocidad de reacción es proporcional al producto de las concentraciones de los reactivos, elevadas a sus respectivos coeficientes estequiométricos. Esta es la llamada ley de acción de masas.
Fíjate en el papel que juega el exceso de una de las sustancias reaccionantes: la cantidad de sustancia de producto formado dependerá sólo del reactivo limitante, por lo que no es posible aumentar la cantidad de producto formado pero sí la velocidad de la reacción.
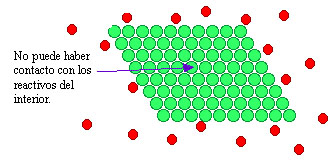
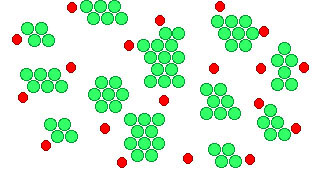
En el caso de reacciones heterogéneas, en las que los reactivos están en fases diferentes, la reacción sólo tiene lugar en la superficie de contacto de las fases, por lo que la velocidad de reacción aumenta mucho al aumentar el área de dicha superficie. Por ello, las reacciones pueden ser muy rápidas si los reactivos sólidos se encuentran finamente divididos, como puedes ver en la imagen. Las condiciones más propicias para que una reacción sea rápida es que se verifique entre gases o en disolución, ya que entonces la división alcanza su grado máximo.
Por la misma razón, cuando se agita la mezcla reaccionante se separan los productos que se han formado a partir de los reaccionantes, y se facilita el contacto entre más reaccionantes, con lo que aumenta la velocidad de reacción.
 |
 |
| Imagen 9 Elaboración propia |
Imagen 10 Elaboración propia |
 |
|
| Imagen 11 Benjah-bmm27, Dominio público |
Imagen 12 Elaboración propia |
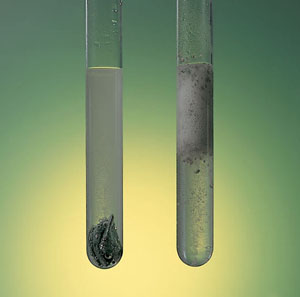
Fíjate en la diferente velocidad de la reacción de disolución del cinc por acción del HCl, en la que se forman burbujas de gas hidrógeno. En el tubo de la izquierda hay granalla de cinc, como la de la imagen, mientras que en el de la derecha hay polvo de cinc. En este último la reacción es mucho más rápida.
Naturaleza de los reactivos
Fíjate en la velocidad que tienen a temperatura ambiente las siguientes reacciones:
- catión hierro (III) (aq) + catión cromo (II) (aq) → catión hierro(II) (aq) + catión cromo(III) (aq) ; muy rápida
- monóxido de nitrógeno (g) + oxígeno (g) → dióxido de nitrógeno (g) ; moderada
- metano (g) + oxígeno (g) → anhídrido carbónico (g) + agua (l) ; muy lenta
¿A qué se debe esta diferencia en las velocidades? La primera reacción no requiere la ruptura ni formación de enlaces, sino que consiste simplemente en un intercambio de electrones de unos iones a otros. La segunda requiere la ruptura del enlace O=O, y la formación de dos nuevos. Por último, la tercera reacción requiere la ruptura de seis enlaces y la formación de otros seis nuevos.
Según se aprecia en estos ejemplos, puede decirse de forma aproximada que, a temperatura ordinaria, las reacciones que no implican un reajuste de enlaces suelen ser muy rápidas. Esto es lo que ocurre en casi todas las reacciones entre iones. En cambio, cuando se requiere la ruptura y formación de varios enlaces, las reacciones suelen ser muy lentas.
Hay incluso reacciones de ecuación estequiométrica compleja como, por ejemplo, la reacción (en disolución acuosa): 5 Fe2+ + 8 H+ + MnO4- → 5 Fe3+ + Mn2+ + 8 H2O que parece que debería ser muy lenta, ya que hay ruptura de cuatro enlaces y formación de ocho y, además, intervienen 14 iones. Sin embargo, experimentalmente se ha comprobado todo lo contrario, es decir, que es muy rápida.
El mármol es carbonato de calcio en su mayor parte, y se disuelve por acción del ácido clorhídrico según la reacción
CaCO3(s) + 2 HCl(aq) →CaCl2(aq) + CO2(g) + H2O(L)
Señala sólo las afirmaciones que son verdaderas:
Si el ácido está diluido, disuelve al mármol lentamente.
| |
El mármol pulverizado se disuelve más rápidamente que el mármol en bloque.
| |
Si agitas la mezcla reaccionante, el mármol se disuelve más despacio.
| |