3.2 Principio de indeterminación de Heisenberg
Enunciado por
Heisenberg en 1927, el principio de indeterminación (también llamado de incertidumbre) afirma que no se puede conocer a la vez y con total
exactitud la posición de una partícula en movimiento y cualquier magnitud
relacionada con su velocidad (velocidad ó momento lineal mv). El producto de los errores cometidos en el caso de masa y velocidad es de 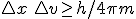 .
.
|
|
| Vídeo 2 Ggrasc, Uso libre |
El carácter ondulatorio del electrón viene asociado cualitativamente a la idea de una cierta deslocalización que impide situar al electrón en un punto determinado, e introduce una cierta indeterminación en el movimiento que puede seguir el electrón, que, en consecuencia, carece de una trayectoria absolutamente determinada.
Una forma de interpretar esta indeterminación es que es una consecuencia del mismo proceso de medida, que, como toda interacción, perturba aquello que se observa, y que solamente se manifiesta en partículas de masa muy pequeña que se mueven a altas velocidades.
De forma simplificada, es imposible "ver" un electrón, porque habría que "iluminarlo", de manera que el electrón absorbería la radiación incidente, incrementaría enormemente su energía cinética y cambiaría su posición, con lo que no podríamos saber dónde estaba. Naturalmente, este hecho es inapreciable en la vida ordinaria (¡tu posición no cambia porque te de la luz del sol!).
La consecuencia más importante es que hay que modificar el concepto de órbita del modelo de Bohr-Sommerfeld, ya que en una órbita se sabe con total exactitud dónde está el electrón -su radio de giro- y la energía que tiene.
La mecánica cuántica propone el concepto de orbital, relacionándolo con la zona del espacio en la que es muy probable encontrar al electrón, por lo que se habla de "nube" electrónica. Es decir, no hay total seguridad sobre su situación, manteniéndose un cierto grado de "incertidumbre".
Al sustituir el valor de la masa del electrón en el principio de indeterminación, se obtiene que: 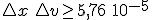 . Es decir, un error en la posición del orden de 1 angstrom (10-10 m), que supone prácticamente el desconocimiento de la situación del electrón, ya que el tamaño del átomo de hidrógeno es de ese orden, lleva a un error en la velocidad de 5,76 105 m/s. Considerando que la velocidad media del electrón es del orden de 3 106 m/s (la centésima parte de la velocidad de la luz), el error en la velocidad es del orden del 20%.
. Es decir, un error en la posición del orden de 1 angstrom (10-10 m), que supone prácticamente el desconocimiento de la situación del electrón, ya que el tamaño del átomo de hidrógeno es de ese orden, lleva a un error en la velocidad de 5,76 105 m/s. Considerando que la velocidad media del electrón es del orden de 3 106 m/s (la centésima parte de la velocidad de la luz), el error en la velocidad es del orden del 20%.
El gato de Schrödinger
Cuando se habla del "gato de Schrödinger" se está haciendo referencia a una paradoja que surge de un célebre experimento imaginario propuesto por Erwin Schrödinger en el año 1937 para ilustrar las diferencias entre interacción y medida en el campo de la mecánica cuántica. Puedes leer este artículo de la revista de divulgación del IES Vitoria Kent "El rincón de la ciencia", así como ver el reportaje del programa de TVE Redes, que se muestra a continuación.
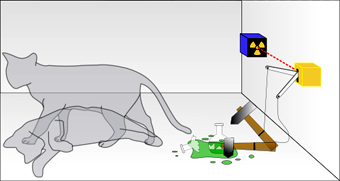 |
|
| Imagen 14 Dhatfiel, Creative commons |
Vídeo 3 Redes TVE2, Uso educativo |
 |
| Imagen 15 XLSemanal 1166, Uso educativo |
¡Hasta en las revistas!
El principio de indeterminación supuso un cambio radical en la concepción del mundo: el paso de la certeza a la probabilidad hizo modificar muchos de los planteamientos de la Física. Por ello, Heisenberg recibió el premio Nobel en 1932.
Pero no solamente es un tema de Física especializada, sino que también se trata en revistas de todo tipo. Eduard Punset es un divulgador de ciencia que tiene unas características muy particulares. Su programa Redes es diferente, y en él se tratan temas científicos en profundidad, buscando la esencia del conocimiento.
Con frecuencia le hacen entrevistas, tanto en televisión como en revistas. Fíjate en lo que está escribiendo en la portada del número 1166 del dominical XLSemanal.
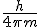 . Es decir, de
. Es decir, de 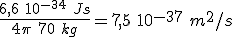 .
.