2. El modelo de Bohr
|
| Imagen 9 Szdori, GNU free |
En 1913, Bohr aplicó la teoría cuántica de Planck y las leyes de la mecánica de Newton al modelo atómico de Rutherford, proponiendo que el átomo está cuantizado; es decir, que el electrón no puede girar a cualquier distancia del núcleo ni tener cualquier energía, sino solamente algunas de entre todas las posibles.
Este modelo se basa en tres postulados:
1. El electrón gira alrededor del núcleo en órbitas circulares estacionarias, en las que el electrón es estable y no emite energía.
2. Solamente son posibles las órbitas en las que el momento angular del electrón es un múltiplo entero de 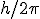 . Es decir,
. Es decir, 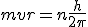
3. Cuando un electrón pasa de una órbita a otra de menor energía, la diferencia energética se emite en forma de fotones, de acuerdo con la ecuación de Planck, dando lugar a los espectros de emisión.
El primer principio va en contra de la física clásica, ya que las partículas cargadas, como los electrones, cuando llevan movimiento acelerado pierden energía, por lo que el electrón debería caer sobre el núcleo. Y el segundo no tiene ninguna base física, ya que Bohr lo introdujo para ajustar sus cálculos a los resultados experimentales.
Cuando se resuelve el planteamiento matemático del modelo, se obtiene que tanto el radio de giro del electrón en las órbitas como sus energías respectivas dependen de un número, n, que limita las posiciones y energías del electrón en el átomo. Tiene valores enteros a partir de 1, y se llama número cuántico principal.
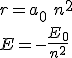
donde 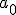 y
y 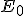 son los valores del radio de giro y de la energía del electrón en la primera órbita, con n=1.
son los valores del radio de giro y de la energía del electrón en la primera órbita, con n=1.
Observa que al aumentar n las óribtas se van haciendo más grandes (con radios a0 , 4a0 , 9a0 y 16a0, ...).
Cuando un electrón pasa de una órbita en la que tiene más energía (n2) hasta otra de menor energía (n1, más interna), emite una radiación correspondiente a esa diferencia energética E = E2 - E1. Teniendo en cuenta la ecuación de Planck,
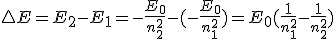
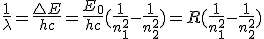
Éste fue el gran éxito de Bohr: aplicando su método, llegó a obtener la misma ecuación experimental a que habían llegado los espectroscopistas, con los mismos valores de la constante R y de los números n1 y n2. ¡Pero ahora tenían un significado físico, relacionado con la situación y energía de los electrones en el átomo!
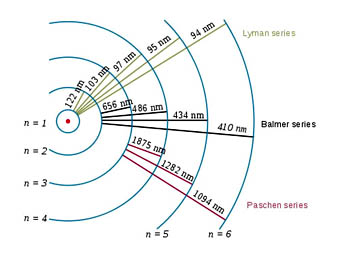
Como habrás observado, se habla de órbitas y de niveles de energía de forma prácticamente indistinta: en un caso se hace referencia a la situación de electrón en el átomo, y en el otro a la energía que tiene en cada una de ellas. En la imagen puedes ver el origen de las series espectrales del hidrógeno.