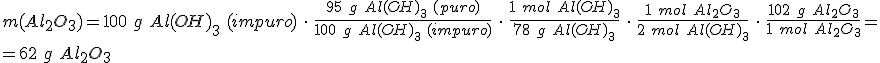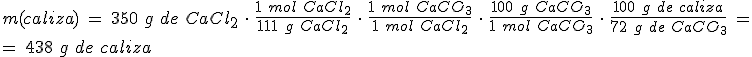4. Reactivos impuros
En general, en las reacciones químicas, los reactivos que se utilizan no se encuentran puros, sino que están mezclados con algunas impurezas. Para realizar cálculos estequiométricos es necesario conocer la pureza del reactivo.
La pureza de un reactivo puede definirse como:


|
| Imagen 13. Rembrandt Peale. dominio público |
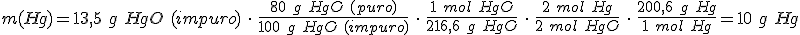
 |
| Imagen 14. Svdmolen. dominio público |
Como se indica en la historia inicial, el aluminio se obtiene a partir de la bauxita, que es un mineral formado principalmente por Al2O3 y que contiene una proporción importante de óxidos de hierro. Para separar el Al2O3 se realiza una serie de reacciones que pasan por la formación de hidróxido de aluminio.
El hidróxido de aluminio, Al(OH)3, se calcina para obtener de nuevo Al2O3 y agua. Si la pureza del Al(OH)3 es del 95%, ¿que masa de óxido de aluminio obtendrás a partir de 100 g de Al(OH)3 impuro?
El óxido de aluminio (Al2O3) se encuentra en la naturaleza no sólo en la bauxita, sino que forma minerales como el corindón, que posee una gran dureza.
Cuando tienen pequeñas cantidades de impurezas, los minerales cuya composición es óxido de aluminio destacan por su extraordinaria belleza. Es el caso de los zafiros, que son Al2O3 con pequeñas cantidades de hierro y titanio, o de los rubíes que contienen algo de cromo.
El aluminio también entra en la composición de otros minerales utilizados en joyería, como los granates, las turquesas o las aguamarinas.
 |
 |
|
| Imagen 15. Zimbres, Creative commons | Imagen 16. Azuncha, Creative commons | Imagen 17. Arpingstone. dominio público |
 |
| Imagen 18. CBDunkerson, dominio público |