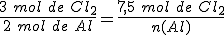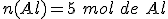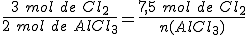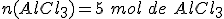3. Reactivos limitante y en exceso
 |
|
Imagen 8. Pluca , Creative Commons
|
Una reacción química se produce en condiciones estequiométricas cuando las cantidades de reactivos (en moles) están en las proporciones idénticas a las de la ecuación química ajustada.
Es frecuente que se use un exceso de alguno de los reactivos para conseguir que reaccione la mayor cantidad del reactivo menos abundante.
El reactivo que se consume en su totalidad es el que va a limitar la cantidad de producto que se obtendrá y se denomina reactivo limitante. Los otros reactivos se llaman excedentes o en exceso y no se consumen totalmente.
¿Cómo puedes saber cuál es el reactivo limitante? Por ejemplo, en la reacción del aluminio con el oxígeno para formar óxido de aluminio, mezclas para que reaccionen dos moles de aluminio con dos moles de dioxígeno.
La ecuación ajustada es : 4 Al + 3 O2 → 2 Al2O3
y haciendo uso de la proporción estequiométrica entre el aluminio y el dioxígeno:
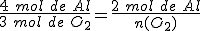
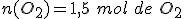
Por tanto, únicamente reaccionan 1,5 moles de O2 y quedan sin reaccionar 0,5 moles de dioxígeno. El reactivo limitante es el aluminio, que se consume totalmente.
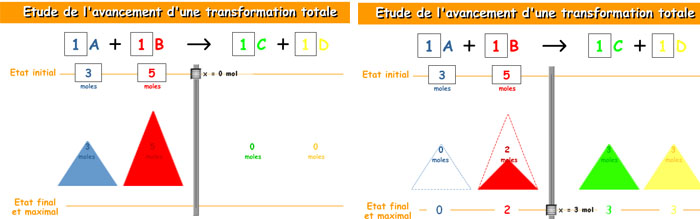
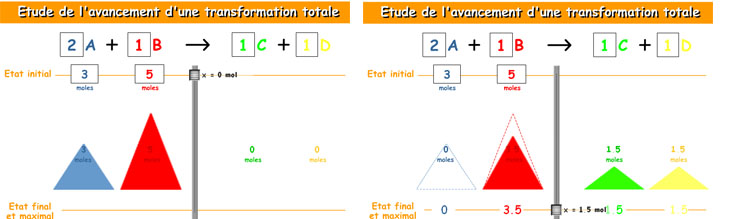
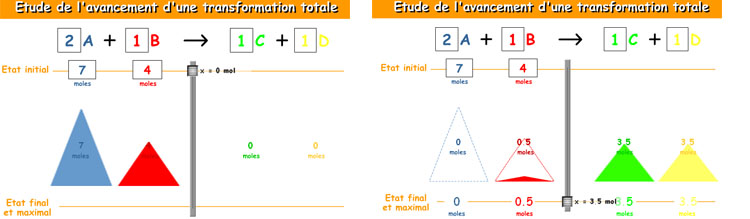
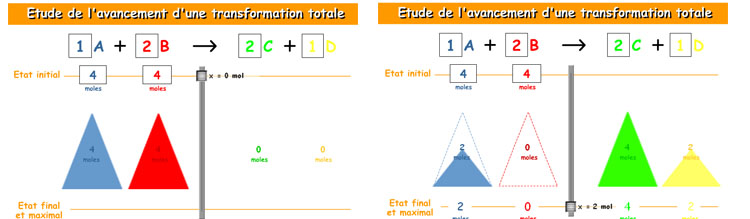
Fíjate en la animación siguiente, que te ayudará a entender el concepto de reactivo limitante y excedente (el título es "estudio de la evolución de una reacción"). En ella se hacen reaccionar dos sustancias (A y B) para formar otras dos (C y D); puedes variar los coeficientes estequiométricos y la cantidad de sustancia inicial de A y de B. Haciendo descender el cursor central la reacción avanza.
Mantén los coeficientes estequiométricos de A, B, C y D como 1 y haz reaccionar 3 moles de A con 5 moles de B. ¿Cuál es el reactivo que se consume totalmente (limitante)? ¿Qué cantidades se forman de C y de D?
Modifica el coeficiente estequiométrico de A y por 2 y haz reaccionar 3 moles de A con 5 moles de B. ¿Cuál es el reactivo que se consume totalmente (limitante)? ¿Qué cantidades se forman de C y de D?
Mantén el coeficiente estequiométrico de A como 2 y haz reaccionar 7 moles de A con 4 moles de B. ¿Cuál es el reactivo que se consume totalmente (limitante)? ¿Qué cantidades se forman de C y de D?
Modifica los coeficientes estequiométricos poniendo 1 en A, 2 en B, 2 en C y 1 en D. Haz reaccionar 4 moles de A con 4 moles de B. ¿Cuál es el reactivo que se consume totalmente (limitante)? ¿Qué cantidades se forman de C y de D?
 |
| Imagen 9. Victorclaessen, Creative commons |
El reactivo limitante es el cloro.
| |
El reactivo limitante es el aluminio.
| |
No reaccionan 0,5 moles de aluminio.
| |
Se forman 5 moles de cloruro de aluminio (AlCl3).
| |