1. Cálculos estequiométricos
 |
| Imagen 2. Corrado Ignoti. Creative commons |
Los datos sobre los reactivos y los productos no se expresan, normalmente, en cantidad de sustancia (moles), sino que se expresan en masa (gramos) o en volumen (litros) de disolución o de un gas. Por ello, es necesario seguir un procedimiento en los cálculos estequiométricos.
Los pasos a seguir son:
1º- Escribe la ecuación química ajustada.
2º- Calcula la cantidad de sustancia en moles de la sustancia dato.
3º- Usa la relación estequiométrica para obtener la cantidad de sustancia en moles de la sustancia incógnita.
4º- Convierte la cantidad de sustancia en moles de la sustancia incógnita a la magnitud pedida.
 |
| Imagen 3. Dorgan. Creative commons |
1º- La ecuación química ajustada es la que has escrito anteriormente:
4 Al + 3 O2 → 2 Al2O3
2º- El dato son los 54 g de aluminio que reaccionan. Como la masa molar del aluminio es M(Al) = 27 g/mol, la cantidad de sustancia de aluminio es:
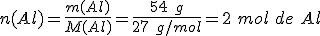
3º- La relación estequiométrica entre el aluminio (dato) y el óxido de aluminio (Al2O3) (incógnita) es:
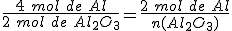
Si despejas la cantidad de sustancia de Al2O3,
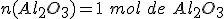
4º- Como te piden la masa de Al2O3 que se obtiene, calculas la masa molar del Al2O3, M(Al2O3) = 102 g/mol, y al final resulta:
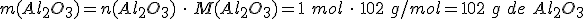
 |
| Imagen 4. Scott Ehardt, dominio público |
Masas atómicas relativas: Ca = 40 ; O = 16 ; C = 12 ; H = 1
 |
|
Imagen 5. Chemik10, Creative commons
|
Masas atómicas relativas: K = 39 ; Cl = 35,5 ; O = 16