2.2. Centro activo y cinética enzimática (I)
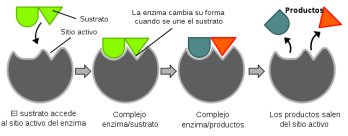
Las enzimas son altamente específicas para las reacciones que catalizan y poseen en su superficie una zona activa, como una especie de hendidura u oquedad, denominada centro catalítico o centro activo, a la que se adapta perfectamente la molécula de sustrato que presente la geometría complementaria a la conformación espacial del centro activo.
Las enzimas pueden realizar su función con los radicales de sus aminoácidos, aunque algunas necesitan además un componente no proteico llamado cofactor. El conjunto enzima-cofactor se conoce como holoenzima.
El cofactor puede ser:
- Un ión metálico (Fe2+, Mg2+, etcétera).
- Un compuesto orgánico llamado coenzima, como el NAD+ y FAD o muchas vitaminas.
Si el cofactor —ión metálico o coenzima— está unido mediante enlace covalente a la parte proteica o apoenzima se le conoce como grupo prostético.
Esta sería su forma de actuar:
|
|
| Imagen 26. Autor: medmol. Autorizado su uso no comercial |

|
|
| Imágenes 27 y 28. Autor: Desconocido. Autorizado su uso educativo no comercial |
|
|
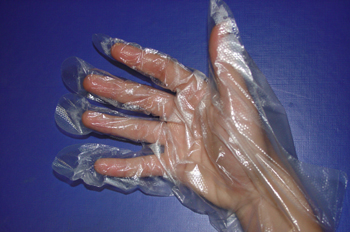
La unión de cada enzima con su sustrato sigue el modelo de llave-cerradura. Cada enzima (cerradura) solo puede unirse (abrirse) con su correspondiente sustrato (llave). Aunque en realidad el centro activo de una enzima no es tan rígido como una cerradura, más bien se parece a un guante que adopta la forma de la mano después de ponerlo. Seguiría así un modelo llamado de acoplamiento inducido, siendo el sustrato el que induce el cambio conformacional específico del centro activo; en este modelo, tanto el sustrato como la enzima se distorsionan.
|
|
|
|
|
Imagen 29. Autor: Timm Vickers. Dominio público
|
|
Bea tiene ya mucha información sobre las proteínas y las enzimas, sus lecturas y su afán investigador han hecho que sea ya casi una experta en esta biomolécula. Pero como siempre que uno estudia, surgen dudas y esta vez Bea ha pensado... ¿tendremos enzimas en la boca?, ¿cuáles serán?, ¿qué función realizarán?
Efectivamente, Bea tiene una duda razonable. Es cierto que en la boca tenemos enzimas que nos ayudan a defendernos de, por ejemplo, las bacterias. Para ayudar a Bea en sus investigaciones, puedes acceder a esta información.
- ¿Qué enzima es la que aparece en nuestra saliva?
- ¿Cómo puede actuar esta enzima para destruir las bacterias?
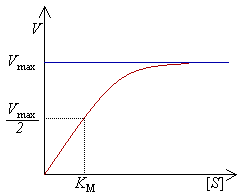
La cinética enzimática estudia la velocidad a la que transcurren las reacciones catalizadas por enzimas.
La actividad enzimática se expresa como la cantidad de moléculas de sustrato que cada molécula de enzima es capaz de transformar por unidad de tiempo, o la cantidad de moléculas de producto que es capaz de producir por unidad de tiempo.
La cinética enzimática responde a la ecuación de Michaelis-Menten, la gráfica está representada en la imagen de arriba. A partir de ella se calcula la constante de Michaelis (KM), un parámetro característico de cada enzima y que se define como la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la velocidad máxima (Vmax).
Esta constante hace referencia a la afinidad de la enzima por el sustrato. Por ejemplo, una enzima con un valor de KM bajo significa que consigue una alta eficacia catalítica aún a bajas concentraciones de sustrato.
 |
|
Imagen 31. Autor: Marisa Cabello Mena para este proyecto.
|
La velocidad de una reacción enzimática depende de varios factores:
- Concentración de sustrato.
- pH.
- Temperatura.
- Activadores.
- Inhibidores.