2. Metales Ligeros
Titanio
De símbolo Ti. Número atómico 22. Densidad 4,45 kg/dm3. Punto de fusión 1800ºC. Resistencia a la tracción 100 kg/mm2.Alargamiento 5%. Resistividad eléctrica 0,8 Ω m2/m.
Obtención. Estado Natural
Para obtener el óxido de titanio se tritura el mineral y se mezcla con carbonato de potasio y ácido fluorhídrico produciendo fluorotitanato de potasio (K2TiF6). Éste se destila con agua caliente y se descompone con amoniaco. Así se obtiene óxido hidratado amoniacal, que se inflama en un recipiente de platino produciendo dióxido de titanio. Se trata el óxido con cloro, obteniéndose tetracloruro de titanio; que se reduce con magnesio para producir titanio metálico, que se funde y moldea en lingotes.

|
 |
| Imagen 18. WikiPedia. Creative Commons | Imagen 19. WikiPedia. Creative Commons |
Aplicaciones
Es muy maleable y dúctil en caliente, debido a su resistencia y su densidad, el titanio se usa en aleaciones ligeras, aleado con aluminio y vanadio, se utiliza en aeronáutica para fabricar las puertas de incendios, el fuselaje, los componentes del tren de aterrizaje. Los cuadros de las bicicletas de carreras. Los álabes del compresor y los revestimientos de los motores a reacción.
Se usa ampliamente en misiles y cápsulas espaciales; las cápsulas Mercurio, Gemini y Apolo fueron construidas casi totalmente con titanio
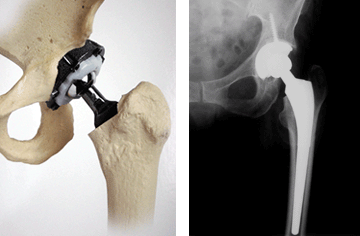
Es eficaz como sustituto de los huesos y cartílagos en cirugía.
Se usa en los intercambiadores de calor de las plantas de desalinización debido a su capacidad para soportar la corrosión del agua salada

|

|
|
Imagen 20. WikiPedia.Creative Commons |
Imagen 21. WikiPedia. Creative Commons |
Sabías que...
 |
| Imagen 22. sorrow. ©sorrow |
Se ha verificado que las incrustaciones de titanio en el organismo humano no provocan ningún tipo de rechazo y además al cabo de un cierto tiempo, se produce la soldadura espontánea y natural de los huesos.
Por ello en la actualidad es el
material más empleado en prótesis e implantes odontológicos y traumatológicos.
Aluminio
De símbolo Al, es el elemento metálico más abundante en la corteza terrestre. Número atómico 13. Densidad 2,69kg/dm3. Punto de fusión 660ºC. Resistencia a la tracción 10 kg/mm . Alargamiento 50%. Resistividad 0,026 Ω mm2/m.
Obtención. Estado natural

|
|
Imagen 23. WikiPedia. Creative Commons
|
También se produce por el método Bayer, que consiste en:
- La bauxita pulverizada se carga en un digestor que contiene una solución acuosa de sosa cáustica a alta presión y a alta temperatura.
- Se forma aluminato de sodio que es soluble en el licor generado.
- Los sólidos insolubles que contiene el licor, como hierro, silicio, titanio y otras impurezas son filtrados y el producto resultante se bombea a depósitos llamados precipitadores.
- En éstos se agregan finos cristales de hidróxido de aluminio, que sirven de simientes, y en torno a ellos van creciendo en las tres dimensiones los cristales de hidróxido de aluminio.
- El hidróxido de aluminio adherido a los cristales se calcina en hornos a 1200ºC. El producto obtenido se refrigera hasta temperatura ambiente, con lo que se obtiene la alúmina para la fusión y obtención de aluminio de buena calidad.
- La alúmina obtenida se procesa en cubas electrolíticas, que funcionan con un baño de ciolita (fluoruro de aluminio sódico), el ánodo es un electrodo de carbón y el cátodo es la propia cuba. Tras este proceso se obtiene el aluminio metálico, que es moldeado y procesado en hornos de concentración para la obtención de aluminio de alta calidad.
Para obtener 1 kg de aluminio se requiere 2 kg de alúmina, los que son producto de 4 kg de bauxita y 8 kwh de energía eléctrica.
Aplicaciones
Debido a su baja densidad es muy útil para construir aviones, vagones ferroviarios y automóviles, y para las aplicaciones en las que es importante la movilidad y la conservación de energía.
Por su elevada conductividad térmica, el aluminio se emplea en utensilios de cocina y en pistones de motores de combustión.
Es fácilmente moldeable por lo que se usa en carpintería de aluminio.
Dada su escasa absorción de neutrones, se utiliza en reactores nucleares.
Es muy maleable por lo que se obtiene papel de aluminio de 0,002 mm de espesor, utilizado para proteger alimentos y otros productos perecederos, por su compatibilidad con comidas y bebidas se usa en envases, envoltorios flexibles, botellas y latas de fácil apertura. El reciclado de estos recipientes supone un gran ahorro de energía.
La resistencia a la corrosión por agua del mar, lo hace útil para fabricar cascos de barco y elementos que estén en contacto con el agua.
Debida a su resistividad eléctrica es el material de elección para sustituir al cobre como conductor eléctrico.

|

|
| Imagen 24. cesjuarez. ©www.cesjuarez.com | Imagen 25. L'Art s.l. ©Professional L'Art s.l. |
Sabías que...

|
| Imagen 26. Wikipedia. Creative Commons |
El calor generado en la reacción del aluminio con el oxígeno es suficiente para fundir el hierro, el proceso llamado termita utiliza este fenómeno para producir soldadura aluminotérmica.