1.2 Explicación cinética del estado de equilibrio
 |
| Simulación 6 Greenbowe, Uso educativo |
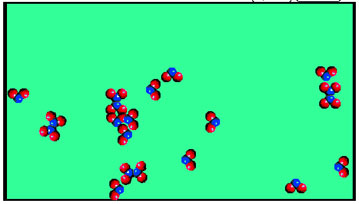
Para entender el proceso de transformación de unas partículas en otras hasta alcanzar el estado de equilibrio, lo más sencillo es utilizar argumentos cinéticos. Observa en la simulación cómo se va disociando el N2O4 y asociándose a la vez el NO2, de forma que las cantidades de ambos son constantes.
Para una reacción sencilla R ↔ P, en la que se parte únicamente de reactivo R, como al principio su concentración es alta, su velocidad de desaparición, y, por tanto, la de formación de P, también lo es; mientras que la reacción inversa es imposible, ya que no hay P formado.
Sin embargo, la concentración de R va disminuyendo, y la de P va aumentando: por tanto, la velocidad de reacción directa (formación de P) va disminuyendo, y la velocidad de reacción inversa (formación de R) va aumentando. Lógicamente, al cabo de cierto tiempo las velocidades directa equilibrio inversa se igualarán: las velocidades de formación y desaparición de R y P serán iguales, y sus concentraciones permanecerán constantes.
Se dice que se ha alcanzado el estado de equilibrio, en el que no varía la composición del sistema. Este equilibrio (como en los equilibrios físicos) es dinámico, ya que, a pesar de que las concentraciones de reactivos y productos son constantes, existe una intertransformación continua de unos en otros.
Para esa reacción, el tratamiento cinético produce los resultados siguientes:
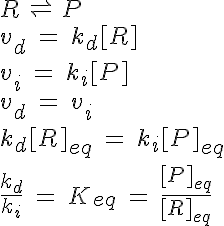
La relación de las dos constantes de velocidad también es otra constante, llamada constante de equilibrio, y que como las anteriores, es función de la temperatura.
Características del estado de equilibrio
- No varían las propiedades observables del sistema a temperatura constante (en particular, la composición y la presión).
- Las velocidades de las reacciones directa e inversa son iguales, por lo que se trata de un estado dinámico.
- Para que se establezca, es necesario que el sistema esté cerrado.
- Puede alcanzarse partiendo de reactivos, de productos o de una mezcla de ambos.
- El equilibrio químico no se alcanza instantáneamente, sino que transcurre un cierto tiempo desde que se pasa de la situación inicial a la de equilibrio, debido a la propia cinética de las reacciones implicadas.
 |
| Imagen 4 Cinta de correr, Uso libre |
En el gimnasio
La situación de equilibrio dinámico se puede comparar a la de una persona que corre sobre una cinta continua, la cual aumenta su velocidad al hacerlo la del corredor. Cuando la persona que corre y la cinta están en equilibrio (es decir, llevan velocidades iguales y de signos contrarios) el corredor está aparentemente estacionario para un observador exterior.
Si el corredor aumenta instantáneamente su velocidad, avanza una cierta distancia sobre la cinta, pero la cinta también se mueve más deprisa hasta que iguala su velocidad a la del corredor, con lo que se vuelve a la situación estacionaria, aunque la posición sobre la cinta queda avanzada respecto de la anterior (se puede decir que se ha desplazado el equilibrio).