4. Termodinámica del equilibrio
 |
| Imagen 8 Gnome, Dominio público |
¿Por qué en unos casos hay cambios de color al transformarse unas sustancias en otras, mientras que en otros el color es constante?
Hasta ahora se ha planteado la situación de equilibrio tomando como base argumentos cinéticos. En este momento vas a ver las ideas fundamentales de sus aspectos termodinámicos.
Espontaneidad y equilibrio
Ya conoces los criterios que pueden aplicarse a un proceso cualquiera a presión y temperatura constantes, tal como una reacción química:
ΔGº > 0 proceso no espontáneo
Una reacción es espontánea si su ΔGº (diferencia entre la entalpía libre de los productos y los reactivos) es negativa, es decir, cuando la entalpía libre de los productos es menor que la de los reactivos, porque en tal caso, la formación de los productos implica una disminución de la entalpía libre G total del sistema (suma de la entalpía libre de los reactivos más la de los productos). Se puede decir que los sistemas químicos evolucionan hacia un mínimo de entalpía libre.
Pero ¿qué sucede cuando la energía libre de Gibbs total de los productos de la reacción es igual a la de los reaccionantes (R↔P)? En ese momento se cumple que ΔG = 0, con lo que no hay una tendencia neta a la intertransformación entre reactivos y productos: se ha alcanzado el estado de equilibrio termodinámico, con lo que permanecen constantes las variables que definen el sistema (presión, volumen, temperatura y composición).
Alcanzando la situación de equilibrio
A partir de las tablas de datos de entalpías libres de formación estándar puedes calcular el valor de la entalpía libre de reacción para cada reacción química.
Si ΔG°< 0 significa que para llegar al equilibrio una parte de los reactivos se ha de convertir en productos, y así disminuirá la entalpía libre total del sistema. Naturalmente, al disminuir la cantidad de reactivos, disminuye su entalpía libre total, mientras que aumenta la de los productos, de los que hay cada vez mayor cantidad. Por tanto, la diferencia de entalpías libres va disminuyendo, hasta que llega a anularse: en ese momento la situación es la de equilibrio (ΔG = 0). Para ello, tiene que haber pocos reactivos, que tienen mucha entalpía libre, y muchos productos, que tienen poca, con lo que el porcentaje de reacción es grande.
Por contra, un valor de ΔG°> 0, significa que para llegar al equilibrio muy pocos reactivos se van a convertir en productos.
También se puede hacer el mismo razonamiento si se parte solamente de productos: se formarán muy pocos reactivos si ΔG°< 0, o muchos si ΔG°> 0.
La entalpía libre en el equilibrio
Los sistemas químicos evolucionan de forma que se alcanza el equilibrio cuando la entalpía libre de los reactivos y productos que hay presentes es la misma, de manera que para esa composición la entalpía libre total de la mezcla es mínima.
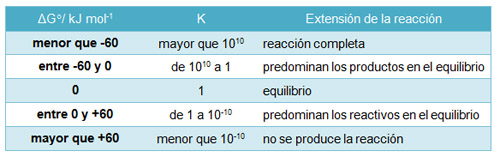
Se suelen considerar de equilibrio las reacciones para las que el valor de K está comprendido entre 10-10 y 10+10, que corresponden a valores de ΔG° comprendidos entre 60 kJ mol-1 y - 60 kJ mol-1. Por encima o por debajo de estos valores límites de ΔG°, la reacción no se produce prácticamente, o tiene lugar de forma completa, respectivamente. Esta situación puede resumirse en el cuadro siguiente:
Este
razonamiento implica que debe existir una relación cuantitativa entre la
variación de entalpía libre normal de una reacción ΔG° y su constante de
equilibrio K. No se va a hacer la deducción de esta relación, pero es útil que conozcas el resultado, que es el siguiente:
donde R es la constante de los gases y T la temperatura absoluta.
Fíjate en que cuanto mayor sea el valor de K, más negativa será ΔGº y más espontáneo será el proceso.
Debes darte cuenta que, en la ecuación anterior, la constante K dependerá del tipo de equilibrio.
- En el caso de equilibrios en fase gaseosa, K = Kp.
- En el caso de equilibrios en disolución, K = Kc.
En la sangre
¿Recuerdas la historia inicial? Los gases CO y O2 se asocian con la hemoglobina, pero se forma preferentemente la sustancia HbCO, que es más estable que la sustancia HbO2. En consecuencia, la constante del equilibrio de formación de HbCO es mayor que la de formación de HbO2.