1.1 Determinación de las ecuaciones de velocidad
La velocidad de reacción es función de las concentraciones de las sustancias que forman parte en la misma. La ecuación que relaciona la velocidad y las concentraciones de las sustancias se denomina ecuación de velocidad.
La ecuación de velocidad se expresa como el producto de una constante por las concentraciones de los reactivos elevadas a una cierta potencia. Para una reacción entre dos sustancias se expresa como:
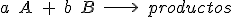
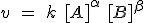
En general, se expresa como el producto de concentraciones de reactivos elevadas a unos coeficientes que se deben determinar experimentalmente:
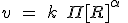
Orden de reacción
El exponente α se llama orden de la reacción respecto al reactivo A (orden parcial). Asimismo, el exponente ß es el orden de la reacción respecto al reactivo B, etc. La suma de todos los exponentes, esto es α + ß + ... se llama orden total de la reacción.
Es importante advertir que los exponentes, α, ß, ... no tienen por qué ser iguales a los coeficientes de la ecuación estequiométrica, a, b, ..., ni tampoco tienen que ser necesariamente números enteros. Los órdenes (parciales y total) de una reacción tienen que determinarse experimentalmente y no se pueden deducir a partir de la ecuación estequiométrica de la reacción.
La constante k que figura en la ecuación de velocidad, se llama constante de velocidad. Su valor es característico de cada reacción y no depende de las concentraciones de los reactivos, pero sí varía mucho con la temperatura. El valor numérico de la constante de velocidad coincide con el valor numérico de la velocidad cuando las concentraciones de los reactivos son la unidad, y permite comparar la velocidad de diferentes reacciones.
¿Cómo se determinan ecuaciones de velocidad?
Para una reacción entre dos sustancias, son necesarios datos experimentales de al menos tres experimentos distintos, ya que hay que determinar tres variables k, α y ß.
Para deducir el orden, puedes seguir esta sencilla regla: buscar dos experimentos en los que varía la concentración del reactivo A y que permanezca constante la del reactivo B. Si se multiplica la concentración de un reactivo A por un valor x (2, por ejemplo) y la velocidad aumenta en un factor de 22, la reacción tiene orden 2 respecto al reactivo A.
En el simulador siguiente tienes cuatro problemas resueltos de determinación de la ecuación de velocidad.
Simulación 2. Elaboración propia
En una reacción del tipo 2 R → P, cuando se duplica la concentración de R, la velocidad de reacción se duplica. ¿Cuál es el orden de reacción?