3. Primer principio de la termodinámica
En todo sistema termodinámico, existen dos formas de aumentar o disminuir su energía:
1. Mediante la realización de un trabajo (W)
Imaginemos una jeringuilla clínica a la que hemos obturado la boca, de forma que no pueda escapar el gas contenido en su interior. Si ahora empujamos el émbolo presionando, el gas se comprime. El sistema termodinámico ha cambiado sus variables, ahora la presión es mayor y el volumen es menor. De hecho, la energía del sistema ha aumentado, como podemos comprobar si dejamos en libertad el émbolo, momento en el que se desplazará en sentido contrario hasta recuperar su posición inicial. La situación es similar a la compresión de un muelle.
La característica del trabajo como transferencia de energía es que el movimiento de las partículas es ordenado, visible a escala macroscópica.
2. Mediante el intercambio de calor (Q)
Otra forma más común para intercambiar calor entre sistemas es a través de su calentamiento; según se vio al comienzo del tema, cuando se ponen en contacto dos sistemas a diferente temperatura se produce una transferencia de energía en forma de calor del cuerpo más caliente hacia el más frío. Este mecanismo es el utilizado para cocinar o calentar una habitación. También en el proceso de cambio de estado debe transferirse calor para que éste se produzca.
Cuando se transfiere energía en forma de calor, éste se transmite en forma de choques a escala de partículas, provocando el movimiento desordenado de las partículas del sistema.
El intercambio de energía entre sistemas puede realizarse de dos formas:
- En forma de trabajo cuando alguna fuerza provoca un desplazamiento.
- En forma de calor cuando existe diferencia de temperaturas o se produce un cambio de estado.
Verdadero Falso
Verdadero Falso
Verdadero Falso
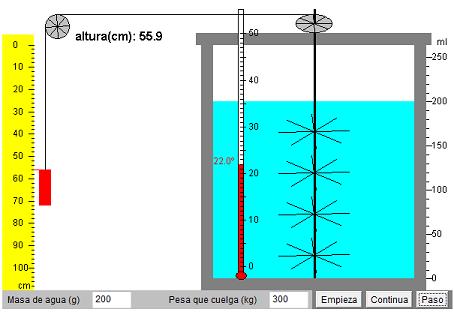 En primer lugar ajustamos los parámetros del simulador a los datos que se nos dan: masa de agua = 200 g, masa de la pesa = 300 kg.
En primer lugar ajustamos los parámetros del simulador a los datos que se nos dan: masa de agua = 200 g, masa de la pesa = 300 kg.