2. El enlace químico
Como acabas de ver, hay cuatro tipos de sustancias, de las que son ejemplos el titanio, el diamante, la calcita y el iodo. ¿Cómo se unen entre sí los átomos para formarlas? ¿Y en el caso de otras sustancias, tales como oxígeno (O2), dióxido de carbono (CO2), ácido clorhídrico (HCl), propano (CH3-CH3), cloruro de sodio (NaCl) o aluminio (Al)?
Seguro que sabes que el dióxido de carbobo es el máximo responsable del efecto invernadero ¿Por qué está formado por dos átomos de oxígeno y uno de carbono unidos entre sí? ¿No podrían ser tres y uno, formándose trióxido de carbono?
 |
| Imagen 8 Laghi.I, Creative commons |
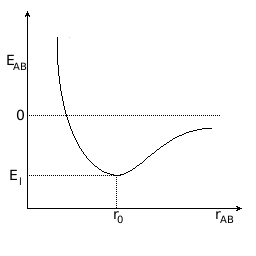
En primer lugar, vamos a analizar por qué se unen los átomos. Imagina que tienes dos átomos A y B situados muy lejos uno de otro. Entre los dos tienen una cantidad de energía determinada (potencial, cinética, etc.), y la energía de interacción es nula. Conforme se van acercando, interaccionan entre ellos, de forma que la situación va siendo progresivamente más estable, de menor energía, como puedes observar en la figura. A una distancia concreta, la energía es mínima porque la interacción es máxima entre los núcleos y los electrones de ambos átomos.
Si los átomos se acercan más, se hace muy apreciable la repulsión eléctrica entre los núcleos, cargados positivamente, con lo que la situación es menos estable. En resumen, los átomos quedan a una distancia concreta r0, que es la distancia de enlace.
Es decir, los átomos se unen porque la energía que tiene un conjunto de átomos cuando están unidos es menor que cuando están separados.
La disminución de energía entre la situación de átomos separados y de átomos unidos tiene un significado real muy sencillo: para separar de nuevo los dos átomos habrá que comunicar precisamente esa cantidad de energía, llamada energía de enlace.
La regla del octete
Se ha observado experimentalmente que los gases nobles no reaccionan. ¿Sus átomos son inertes por alguna razón especial?
Además, se ha observado que los átomos tienden a quedarse con la última capa electrónica completa, con ocho electrones: esta observación se generaliza denominándose regla del octete.
Regla del octete
Los átomos se unen a otros átomos para tener su capa electrónica más externa completa, con 8 electrones, adquiriendo estructura de gas noble.