1.2 Grupos
Ya se ha indicado que en un mismo grupo se sitúan elementos químicos de propiedades similares, pero ¿por qué esta semejanza en las propiedades?
Fíjate en la configuración electrónica de los tres primeros elementos del grupo 2:
| Elemento |
Símbolo | Z |
Configuración electrónica |
| Berilio | Be |
4 |
1s2 2s2 |
| Magnesio | Mg |
12 |
1s2 2s2 2p6 3s2 |
| Calcio | Ca |
20 |
1s2 2s2 2p6 3s2 3p6 4s2 |
¿Observas algo en común en todos ellos? Resulta evidente que todos ellos tienen la misma configuración electrónica en su nivel más externo. Concretamente, en este caso, dos electrones en el subnivel s. De hecho, la configuración de su capa de valencia es del tipo ns2. El hecho de compartir esta configuración hace que, a la hora de formar enlaces y reaccionar con otras sustancias, tengan un comportamiento químico similar.
Esta característica es generalizable a todos los grupos de la tabla periódica:
Los elementos de un mismo grupo de la tabla periódica tienen la misma configuración electrónica en su nivel de energía más externo. Esta similitud provoca que todos ellos, así como sus compuestos, tengan propiedades químicas similares.
En la siguiente imagen puedes observar cómo los grupos están caracterizados por el tipo de orbital en el que se ubica su último electrón.
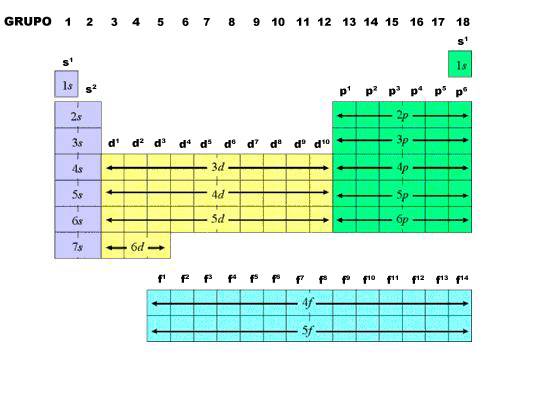 |
| Imagen 8. Elaboración propia |
Un resultado interesante que puede derivarse de esta clasificación es que puede conocerse el grupo al que pertenece un elemento conociendo simplemente su número atómico, a partir de su configuración electrónica. También es cierta la afirmación inversa.
Dados los elementos A, B, C, D, E que tienen como número atómico 3, 9, 10, 19, 36 respectivamente:
a) ¿Pertenecen algunos de ellos al mismo grupo?
b) ¿Cuál o cuáles pertenecen al grupo 18?
Entre los 18 grupos que forman la tabla periódica, algunos reciben nombres especiales por su importancia. Entre ellos cabe destacar:
- Alcalinos (Grupo 1). La configuración electrónica de su última capa es ns1. Por ello, pierden fácilmente un electrón para tener completa su última capa. Por ello son metales que tienen un número de oxidación +1, son muy reactivos, formando iones, y no se encuentran en estado puro en la naturaleza.
- Alcalinotérreos (Grupo 2). En ellos la configuración electrónica de su última capa es ns2. Son metales con número de oxidación +2, ya que pierden fácilmente estos dos electrones. Son reactivos, pero menos que los alcalinos, formando iones.
- Halógenos (Grupo 17). Reciben este nombre del griego "Generadores de sales". La configuración electrónica de su última capa es del tipo np5, por lo que son elementos no metálicos que ganan fácilmente un electrón para completar su última capa, formando iones negativos del tipo X-1. Reaccionan fácilmente con los alcalinos y alcalinotérreos para dar lugar a sales binarias y en la naturaleza los más ligeros forman moléculas diatómicas.
- Gases nobles (Grupo 18). Tienen todas sus capas completas, siendo su configuración electrónica del tipo np6 (con la excepción del Helio, que no tiene capa tipo p). Como no tienen tendencia a reaccionar, son inertes y permanecen en estado gaseoso, por lo que se les llama gases nobles.
El número atómico del cloro es 17.
¿A qué grupo pertenece? ¿Cuál es el ión más probable al que dará lugar?