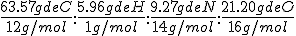5. Determinación de las fórmulas de las sustancias
En primer lugar, hay que determinar la proporción de átomos de cada tipo en el compuesto; es decir, la fórmula empírica. Por ejemplo, (CxHyOz)n significa que en la sustancia hay x átomos de C por cada y átomos de H por cada z átomos de O. Si es una molécula, su fórmula será CxHyOz, C2xH2yO2z, C3xH3yO3z, etc, ya que en todos esos casos la proporción es la misma; para concretar la fórmula molecular habrá que saber también la masa relativa o la molar.
Para determinar la fórmula empírica se necesita saber la masa de cada elemento que hay en una cantidad determinada de compuesto, que se da directamente o se puede obtener a partir de otros datos. También se puede facilitar la composición centesimal, ya que indica la masa de cada elemento que hay en 100 g de compuesto.
Para pasar del nivel experimental (masas de cada elemento) al atómico (número de átomos de cada tipo), se calcula la cantidad de sustancia de cada elemento.
masa ------> cantidad de sustancia ------> número de átomos
Las proporciones de combinación en masas o cantidades de sustancia se indican con dos puntos (:). Se deben escribir con suficiente número de cifras significativas (tres al menos).
Como la proporción de átomos en el compuesto ha de ser necesariamente de números enteros (no hay fracciones de átomo), es necesario hacer la transformación correspondiente. Para ello, se divide cada número de la proporción por el más pequeño de ellos, y se transforma el resultado a proporción de números enteros.
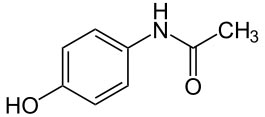
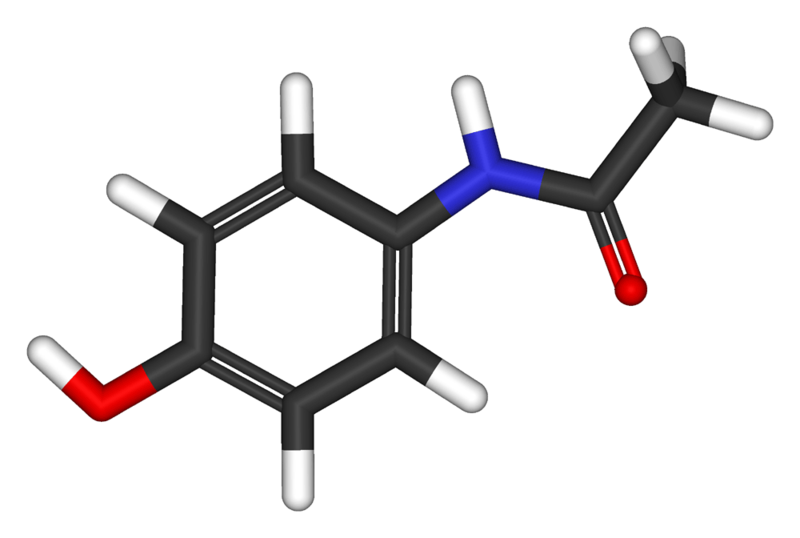
La composición centesimal del paracetamol es 63.57% de carbono, 5.96% de hidrógeno, 9.27% de nitrógeno y el resto de oxígeno. Si su masa molecular relativa es 151, determina su fórmula molecular.
Observa las imágenes siguientes: en la primera aparece el peso de una cápsula de porcelana, en la segunda el peso de un trozo de cinc colocado dentro de ella y en la tercera, el cloruro de cinc formado por reacción del cinc anterior con ácido clorhídrico. Determina la fórmula del cloruro de cinc.
 |
 |
|
| Imágenes 13, 14 y 15 de elaboración propia |
||
CO2
| |
N2O
| |
CH3CH2OH (etanol)
| |
C3H8 (propano)
| |