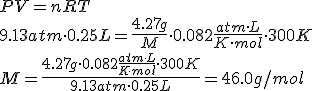4.1 Determinación de masas molares
La determinación de masas molares es muy importante porque permite identificar sustancias, ya que a cada una, con una fórmula concreta, le corresponde una masa molar: el agua es H2O y su masa molar es de 18 g/mol, mientras que el agua oxigenada es H2O2 y su masa molar es 34 g/mol.
Además
de utilizando métodos específicos (espectrometría de masas, crioscopía), se
pueden determinar masas molares de gases utilizando la ecuación de los gases:
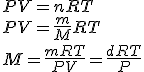
siendo d la densidad del gas (m/V).
12.03 g de una sustancia gaseosa ocupan un volumen de 6125 mL en condiciones normales. ¿Cuál es la masa molar de la sustancia?
|
26.2
| |
|
44.0
| |
|
52.1
|
Cuando se inyectan 4.27 g de un gas en un recipiente de 250 mL a 27ºC, la presión que genera el gas es de 9.13 atm. ¿Qué masa molar tiene el gas?
¿De qué gas de entre los siguientes puede tratarse, teniendo en cuenta el resultado anterior?
|
NO
| |
|
N2O
| |
|
NO2
|
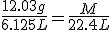 Despejando, M=44.0 g/mol
Despejando, M=44.0 g/mol