5. Aplicaciones de las reacciones redox
Tipos de pilas
Evidentemente, interesan pilas que tengan una diferencia de potencial elevada, para que puedan realizar el máximo trabajo eléctrico posible. Además, su construcción debe ser sencilla y han de resultar de fácil manejo.
La pila Daniell es un ejemplo de pila húmeda y no posee estas características, ya que es frágil e incómoda (¿imaginas tener que llevar semejante dispositivo de un sitio a otro?). Igual sucede con la pila Leclanché, que usa un electrodo de cinc y otro de carbono, rodeado este último por dióxido de manganeso con cloruro amónico como electrólito.
Las pilas que más se usan y que ya conoces son las pilas secas, que son una modificación de la pila Leclanché en la que la disolución se ha sustituido por una pasta sólida. El potencial de esta pila es de 1,5 voltios y es independiente del tamaño o cantidad de reactivos que lleve, ya que con el tamaño aumenta la corriente eléctrica que produce, pero no el voltaje entre los electrodos. Por supuesto, como los reactivos se van transformando con el uso, llega un momento en que la pila se agota (está descargada).
Otras pilas de este tipo son las pilas alcalinas de manganeso-cinc (MnO2-Zn) y de cadmio-mercurio (Cd-HgO), en las que las reacciones se producen en medio básico, caracterizadas por mantener un voltaje más elevado durante un tiempo mayor.
Existen otras pilas, llamadas secundarias, acumuladores o baterías, capaces de regenerar los reactivos por aplicación de corriente eléctrica. Cuando se descargan, la energía química se transforma en eléctrica, mientras que se produce el proceso contrario en la carga. Un ejemplo muy utilizado es la batería del teléfono móvil.
En la simulación siguiente tienes un panorama general de los tipos de pilas que hay en el mercado. Es importante que diferencies los tipos que hay, además de alguna de sus ventajas e inconvenientes, así como su uso.
|
|
| Simulación 5 Consumer, Uso educativo |
Prevención de la corrosión
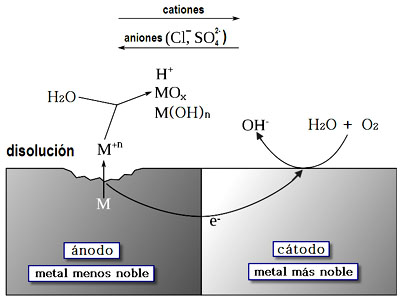
Es imprescindible que los metales no se oxiden para que mantengan sus propiedades mecánicas: si se oxidasen las vigas de hierro, los edificios podrían caer. Existen muchos tipos de tratamiento: pintar el metal, recubrirlo con una capa de otro metal más resistente, o bien protegerlo de la forma que puedes ver en la imagen.
Fíjate en que el metal más noble no se oxida, sino que lo hace el menos noble (el más reactivo). Por ejemplo, las conducciones de hierro se pueden proteger con ánodos de cinc, que se van oxidando y que cada cierto tiempo hay que reemplazar.
 |
 |

|
| Imagen 13 Martín, Creative commons |
Imagen 14 Ktoetx, Dominio público |
Imagen 15 Aeegy, Creative commons |
Reciclaje de pilas
En la historia inicial has visto la enorme cantidad de pilas que se consume anualmente en España, así que puedes hacerte una idea de las que se utilizan en el mundo. Es necesario reciclarlas (fíjate en el símbolo de reciclado de las pilas de litio), llevándolas a contenedores que se tratan en plantas especializadas. De esta forma se evita que los metales pasen a las corrientes de agua y al terreno si se depositan en vertederos.
Pilas de combustible
Son dispositivos en los que la fuente de energía química que produce la corriente eléctrica se almacena en depósitos externos, que se pueden recargar. Actualmente ya hay autobuses de hidrógeno circulando por muchas ciudades. En el simulador siguiente puedes ver su funcionamiento.
|
|
| Simulación 6 Consumer, Uso educativo |
Síntesis electrolítica del aluminio
|
|
| Vídeo 3 Cosmolearning, Uso libre |
Una gran cantidad de metales y productos químicos industriales importantes se obtienen por electrolisis (aluminio, sodio, cloro, hidróxido sódico,etc).
El método de producción del aluminio no es precisamente moderno, ya que el método industrial utilizado es el proceso Bayer, que fue patentado por Karl Bayer en 1889. La bauxita, utilizada como materia prima, se transforma en alúmina, Al2O3, que se utiliza para producir aluminio mediante electrólisis según el proceso denominado de Hall-Heroult. Para ello se disuelve en un baño fundido de criolita (Na3AlF6) y se electroliza en una celda electrolítica usando electrodos de carbono, siendo la reacción producida:
2 Al2O3 → 4 Al (l) + 3 O2 (g)
Puedes ver el proceso en el vídeo.
Por el elevado punto de fusión, el consumo energético necesario para obtener aluminio es muy elevado y lo convierte en uno de los metales más caros de obtener, resultando mucho más rentable el reciclado del mismo (¡hay que reciclar las latas de refrescos!).
 |
| Imagen 16 Henning, Dominio público |
Recubrimientos metálicos
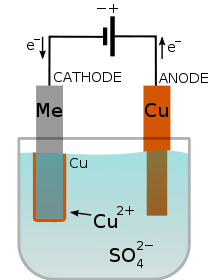
La galvanoplastia es una de las aplicaciones más importantes. Consiste en aplicar una delgada capa de metal sobre una superficie conductora de corriente: el cromado da a los metales una superficie brillante, el acero se galvaniza con cinc para protegerlo de la corrosión, los metales se platean o doran por galvanoplastia, etc.
El objeto que va a recubrirse hace de cátodo en el circuito, y se sumerge en un baño electrolítico que contiene los iones que se desea depositar. Controlando la intensidad de la corriente y el tiempo de electrolisis se puede fijar el espesor y cantidad de capa depositada.
En la imagen puedes ver el cobreado de un metal: se oxida el cobre del ánodo, que pasa en forma de iones a la disolución, y se deposita en el cátodo sobre el metal a recubrir de cobre.
La batería de los coches
El modelo de acumulador más tradicional es el de plomo: la batería de acumuladores de los coches está formada por seis acumuladores de plomo asociados en serie, siendo su voltaje de 12 voltios.
El electrodo positivo es de dióxido de plomo, y el negativo de plomo, sumergidos en una disolución de ácido sulfúrico.
El estado de la batería se comprueba por la densidad del electrolito: una densidad baja indica que la concentración de sulfúrico es pequeña y la batería está parcialmente descargada (la disolución de sulfúrico es más densa que el agua). También lo indica la aparición de un precipitado blanco de sulfato de plomo en los electrodos.
En la simulación tienes una información sencilla y completa del funcionamiento de la batería de los coches.
|
|
| Simulación 7 Consumer, Uso educativo |