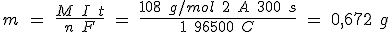4.1 Ley de Faraday
El proceso en que un metal X se deposita en un electrodo por procedimientos electrolíticos se puede representar mediante la ecuación Xn+ (aq) + n e- → X (s), lo que significa que por cada mol de X depositado circularán n moles de electrones.
La carga eléctrica contenida en un mol de electrones se obtiene multiplicando la carga del electrón (e) por el número de Avogadro (NA). La nueva constante obtenida se denomina Faraday (F).
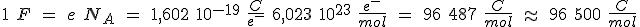
Es decir, para depositar un mol de X se necesitan n faradays (96500 C). Como la proporción de reacción es constante, si circula una intensidad de corriente I durante un tiempo t, la carga eléctrica Q será Q = I t y depositará una masa m del metal de masa molar M. En consecuencia:
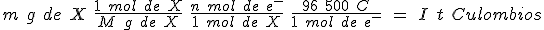
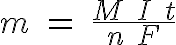
Está relación fue descubierta hacia 1832 por el físico inglés M. Faraday y recibe el nombre de ley de Faraday. Esta ley se aplica al desprendimiento de cualquier elemento, tanto en el cátodo, caso de la deposición de metales, como en el ánodo, caso de los gases. En el esquema puedes ver la ley de Faraday, indicándose en cada caso la magnitud y su unidad.
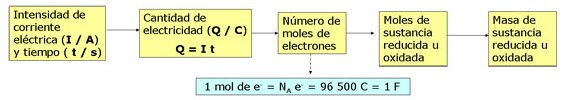
La cantidad de sustancia obtenida en un electrodo durante la electrolisis es directamente proporcional a la cantidad de corriente eléctrica que ha circulado por la disolución.
| |
La cantidad de sustancia obtenida en un electrodo durante la electrolisis es inversamente proporcional al tiempo durante el cual ha circulado la corriente eléctrica.
| |
Para una misma cantidad de corriente circulante por la disolución, la cantidad de sustancia obtenida en un electrodo depende de la carga del ión que se deposita.
| |
Utiliza el simulador siguiente para resolver las cuestiones planteadas. Aunque está en inglés, seguro que no tienes dificultades; fíjate en que para hacer una nueva experiencia debes pulsar "New trial", y en que las pestañas se abren o se cierran pulsando sobre su nombre (abajo a la derecha tienes los datos de potenciales normales de reducción, que necesitarás).
|
|
| Simulación 4 Greenbowe, Uso educativo |
Quieres platear un trozo de hierro. Elige plata (silver) como electrodo de la izquierda (oxidación) y hierro (iron) como electrodo de la derecha (reducción). La disolución deberá ser de iones plata. La intensidad será de 2 amperios y el tiempo de 5 minutos. Pon el conmutador en On una vez seleccionados todos los parámetros del experimento.
a) ¿Qué potencial mínimo debes seleccionar para que se produzca la reacción?
b) ¿Qué cantidad de plata se deposita en el hierro en esos 5 minutos? Comprueba el resultado aplicando la ley de Faraday.
c) Si el tiempo de electrolisis pasase a ser de 10 minutos y la intensidad de 1 amperio ¿qué cantidad de plata hubiese desaparecido del electrodo de plata?