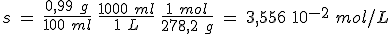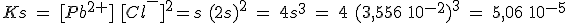2.1 La constante de solubilidad
Siendo rigurosos, no se puede decir que una sal sea completamente insoluble. Aún en las sustancias menos solubles, existe un equilibrio entre la sustancia sólida sin disolver y sus iones en disolución.
Así, por ejemplo, si disuelves una sal poco soluble como el AgCl en agua, se establecerá el siguiente equilibrio: AgCl (s) + H2O ↔ Ag+ (aq) + Cl- (aq) En las llamadas sales insolubles, este equilibrio está casi totalmente desplazado hacia la izquierda, pero existen unas concentraciones (aunque muy pequeñas) de iones Ag+ y Cl-, que deben cumplir con la ley del equilibrio químico, esto es:
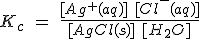
Como la concentración de la sal sólida sin disolver es constante y la del agua en disoluciones diluidas como la presente también, se puede escribir que:
donde Ks es la llamada constante de solubilidad o producto de solubilidad.
Por esta razón no se escribe nunca el agua como reactivo:
AgCl (s) ↔ Ag+ (aq) + Cl- (aq)
La expresión de Ks depende de la estequiometría del compuesto: no es lo mismo que se forme un catión y un anión, que se formen dos y uno, etc.
En la tabla puedes ver algunos ejemplos, en los que s es la solubilidad de la sustancia en mol/L.
| Equilibrio de solubilidad | Expresión de Ks | Relación entre Ks y s |
| AgBr (s) ↔ Ag+ (aq) + Br-(aq) | Ks = [Ag+] [Br-] |
Ks = s s = s2 |
| Ag2CrO4 (s) ↔ 2 Ag+ (aq) + CrO42- (aq) | Ks= [Ag+]2 [CrO42-] | Ks = (2s)2 s= 4s3 |
| Cu(OH)2 (s) ↔ Cu2+ (aq) + 2 OH-(aq) | Ks= [Cu2+] [OH-]2 |
Ks = s (2s)2= 4s3 |
| Al(OH)3 (s) ↔ Al3+ (aq) + 3 OH-(aq) | Ks= [Al3+] [OH-]3 | Ks = s (3s)3= 27s4 |
Determinación de solubilidades y constantes de solubilidad
Teniendo el dato de Ks puedes conocer la solubilidad de la sustancia y, al revés, conociendo la solubilidad (expresada como concentración) puedes calcular Ks.
¿Qué cantidad de agua hace falta para disolver un gramo de sulfuro de mercurio(II)?
Se trata de que te hagas una idea visual de lo que significa que una sustancia es muy poco soluble. El equilibrio de solubilidad es:
HgS(s) ↔ Hg2+(aq) + S2-(aq)
La constante de solubilidad tiene un valor de 3 10-53, extraordinariamente pequeño. Siendo s la solubilidad del sulfuro de mercurio(II) en mol/L,
Ks(HgS) = [Hg2+] [S2-]; 3 10-53 = s2; s = 5,48 10-27 mol/L
Para pasar el valor anterior a g/L debemos tener en cuenta la masa molar de la sustancia. Para el HgS, su masa molar es 232,5 g/mol. Así, tenemos:
s = 5,48 10-27 mol/L·232,5 g/mol = 1,27 10-24 g/L
Es decir, en un litro de agua se disuelven 1,27 10-24 g de HgS. ¿Qué significa esa cantidad? ¿Cuánta agua hace falta para disolver un gramo de HgS? Como 1 g es una cantidad 7,85 1023 veces mayor que 1,27 10-24 g, hacen falta precisamente 7,85 1023 litros de agua.
Si esa cantidad de agua estuviese contenida en un cubo, su lado debería tener nada menos que 9224 km. Considerando que la Tierra es una esfera de 6370 km de radio, su volumen es de 1,08 1024 dm3 (recuerda que 1 litro y 1 dm3 ocupan el mismo volumen), con lo que el volumen de agua necesario para disolver tan solo un gramo de HgS sería ¡el 73% del volumen de la Tierra!
|
Ag2S
| |
|
2AgS
| |
|
AgS2
| |
|
AgS
|