2.1 Cambios de temperatura
La temperatura es el único factor que hace variar el valor de la constante de equilibrio: el estado de equilibrio se rompe al calentar o enfriar no porque cambie el cociente de reacción, sino porque lo hace la constante de equilibrio.
¿Cómo se modifica la constante de equilibrio al cambiar la temperatura? Fíjate en la tabla de datos siguiente.
| Reacción | ΔH0 | T / K | Kc |
| H2(g) + Cl2(g) ↔ 2 HCl(g) | < 0 ; exotérmica | 300 | 4,0 1031 |
| 500 | 4,0 1018 | ||
| 1 000 | 5,1 108 | ||
| H2(g) + I2(g) ↔ 2 HI(g) | < 0 ; exotérmica | 298 | 794 |
| 500 | 160 | ||
| 700 | 54 | ||
| Cl2(g) ↔ 2 Cl(g) | >0 ; endotérmica | 1 000 | 1,2 10-7 |
| 1 200 | 1,7 10-5 | ||
| I2(g) ↔ 2 I(g) | >0 ; endotérmica | 800 | 3,1 10-5 |
| 1 000 | 3,1 10-3 |
Observa que al aumentar la temperatura la constante de equilibrio aumenta si la reacción es endotérmica y disminuye si es exotérmica. Al calentar, una parte del calor comunicado no sirve para aumentar la temperatura, sino que se invierte en aumentar la energía química, produciéndose la reacción en el sentido endotérmico. De esta forma, el sistema evoluciona oponiéndose a la acción externa, y el aumento de temperatura es menor del esperado.
Fíjate en que en este caso se rompe la igualdad entre Q y K porque varía K, mientras que en el caso de la cantidad de sustancia y del volumen se debía a que variaba Q.
El efecto de los catalizadores
Los catalizadores cambian las energías de activación directa e inversa, pero no cambian la energía libre de Gibbs de reacción (recuerda que es una función de estado) y, por tanto, tampoco cambian la constante de equilibrio. Puesto que tampoco alteran el cociente de reacción, no influyen en la condición de equilibrio y no tienen ningún efecto sobre el equilibrio. Lo único que pueden provocar es que el equilibrio se alcance antes.
| Vídeo 2 Nuclearrabbit, Uso libre |
Ahora vas a analizar la disociación del N2O4 en NO2. En el vídeo puedes observar lo que sucede cuando se calienta una mezcla de ambos gases en equilibrio. Ten en cuenta que para producirse la reacción se debe romper el enlace entre los átomos de nitrógeno, con lo que el proceso es endotérmico, y que los gases NO2 y N2O4 son rojizo e incoloro, respectivamente.
a) Escribe el equilibrio de disociación del N2O4.
b) Cuando se calienta y cuando se enfría, ¿la mezcla se aclara o se oscurece?
c) ¿En qué sentido evoluciona el sistema al calentar?
d) Deduce el carácter térmico del proceso a partir de estos datos.
Temperatura y equilibrio
Al aumentar la temperatura, el sistema evoluciona en el sentido endotérmico, y al disminuirla en el exotérmico.
La ecuación de Van´t Hoff
La relación entre variación de temperatura y carácter térmico la estableció Van´t Hoff y se expresa cómo:
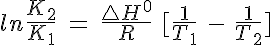
Fíjate en que si sabes el valor de la constante K1 a una temperatura T1, puedes determinar el valor de K2 a T2. Si el proceso es endotérmico (ΔHº>0), si T2 es mayor que T1 la diferencia entre corchetes es positiva y el segundo miembro de la igualdad también, por lo que el logaritmo neperiano es mayor que 0 y K2 es mayor que K1: la constante aumenta y el sistema evoluciona hacia la derecha al calentar, en el sentido endotérmico.
|
|
| Vídeo 3 FisQuiWeb, Uso educativo |
Observa el vídeo siguiente, en el que se pone de manifiesto la influencia de la temperatura sobre el equilibrio entre dos iones complejos que tienen un color que permite diferenciarlos: [Co(H2O)6]2+, de color rojo, y [CoCl4]2-, de color azul.
[Co(H2O)6]2+ + 4 Cl- ↔ [CoCl4]2- + 6 H2O
Fíjate en cómo cambia la situación al calentar y al enfriar. Con esos datos, deduce el carácter térmico del equilibrio tal como está escrito.
|
Endotérmico.
| |
|
Exotérmico.
| |
|
Puede ser endotérmico o exotérmico.
| |
|
Ni endotérmico ni exotérmico.
|
