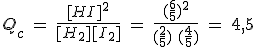1. Cociente de reacción y estado de equilibrio

|
|
Imagen 2 |
Ya has visto que el estado de equilibrio se alcanza partiendo de composiciones iniciales diferentes, y que se establecen estados de equilibrio distintos, pero que tienen en común la relación de concentraciones según la ley de acción de masas: la constante de equilibrio (¡recuerda el trabajo que has hecho con simuladores en el tema anterior!).
Precisamente el conocimiento de la constante de equilibrio de una reacción te va a permitir decidir si un sistema está en equilibrio o no, y el sentido en que evoluciona el sistema para alcanzar el equilibrio, para unas concentraciones dadas de las sustancias que intervienen.
Con ese fin vas a utilizar el cociente de reacción Q, que se calcula utilizando la misma expresión de la constante de equilibrio pero con una composición del sistema que puede ser o no de equilibrio.
- Si la composición es tal que Qc = Kc es que el sistema está en equilibrio, y si son diferentes el sistema va a evolucionar hasta alcanzarlo.
- En el caso de que Qc sea menor que Kc , Qc debe aumentar hasta igualarse a Kc. ¿Cómo lo hace? Evolucionando el sistema hacia la derecha, con lo que aumenta la concentración de productos, disminuye la de reactivos y aumenta Qc.
- Si por el contrario, Qc es mayor que Kc, el sistema evoluciona hacia la izquierda para alcanzar el estado de equilibrio.
El mismo razonamiento es válido si la comparación se establece entre Qp Y Kp.
Cociente de reacción y estado de equilibrio
La relación de concentraciones de productos y reactivos, análoga a la constante de equilibrio pero en cualquier situación, no necesariamente de equilibrio, se llama cociente de reacción, Q.
- Si Q=K el sistema no evoluciona, porque está en equilibrio.
- Si Q<K el sistema evoluciona hacia la derecha para alcanzar el equilibrio.
- Si Q>K el sistema evoluciona hacia la izquierda para alcanzar el equilibrio.
Simulación 1. Elaboración propia
El simulador anterior te va a permitir comprobar cómo evoluciona un sistema hacia el equilibrio a partir de una determinada composición inicial. Puedes elegir entre once sistemas, escribir las cantidades de sustancia iniciales, el volumen y la constante de equilibrio. El avance de la reacción es el cambio de cantidad de sustancia producido para ver cómo evoluciona el sistema al comparar Q con K. Debes ir cambiando ese parámetro, aproximando su valor hasta que Q coincida con K: entonces el simulador ya indica que la situación es de equilibrio.