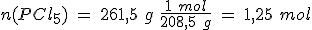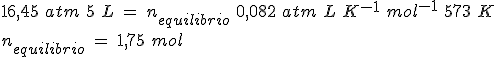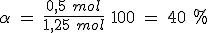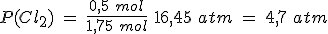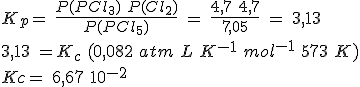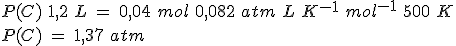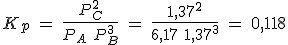3.1 Mezclas de gases
En este tema y en el siguiente los cálculos se van a centrar en equilibrios entre gases. Por tanto, vas a trabajar con presiones y con Kp en lugar de con concentraciones y Kc.

|
| Imagen 7 Elaboración propia |
Como va a haber una mezcla de gases, en equilibrio o no, conviene que utilices la presión parcial de cada uno de ellos. Cuando tiene nA moles de un gas A en un recipiente de volumen V a temperatura T, produce una presión PA, que puedes calcular a partir de la ecuación de los gases (izquierda). Si introduces nB moles de otro gas B en un recipiente de igual volumen y a la misma temperatura, la presión será PB (centro). Como la presión depende de la cantidad de sustancia de gas y no de su tipo (principio de Avogadro), si hay el doble de gas de B que de A, la presión que generará también será doble: la presión es proporcional a la cantidad de sustancia.
Pero ¿qué sucede cuando en un tercer recipiente, en las mismas condiciones de V y T que antes, se introducen los dos gases a la vez? Si piensas un poco, te darás cuenta de que como la cantidad total de sustancia es nA + nB, la presión total será PA + PB (derecha). A esos valores de presión en la mezcla se les llama presiones parciales de cada uno de los gases, y es la presión que cada uno de ellos produciría si estuviese sólo en el recipiente. Se trata de una situación hipotética, ya que en realidad los gases están mezclados.
Como acabas de ver, la presión total es la suma de las presiones parciales. Puedes trabajar calculando cada una de ellas mediante la ecuación de los gases, o bien utilizar la relación entre la presión parcial y las fracciones molares (fracción de moles de cada gas en la mezcla).
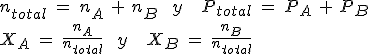
Teniendo en cuenta la relación de proporcionalidad entre cantidad de sustancia y presión, puedes escribir:
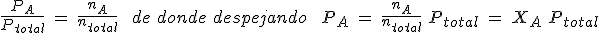
En general, la presión parcial de un gas es su fracción molar por la presión total.
En un recipiente de 5 litros mantenido a 300ºC en el que previamente se ha hecho el vacío, se introducen 261.5 g de PCl5(g) y se cierra, estabilizándose la presión cuando alcanza un valor de 16.45 atmósferas al establecerse el equilibrio PCl5(g) ↔ PCl3(g) + Cl2(g).
Calcula el grado de disociación, las presiones parciales de los gases y los valores de Kc y Kp.