1. Energía química
Como ya sabes, la realización de una reacción química entre sustancias moleculares supone la ruptura de una serie de enlaces en las moléculas de las sustancias reaccionantes y la creación de otros nuevos enlaces para dar lugar a nuevas moléculas. Como no todos los enlaces tienen la misma fuerza de unión entre los átomos (no tienen la misma energía de enlace), ni tampoco se crean ni se rompen el mismo número de enlaces, la reacción tiene lugar siempre con variación de energía.
La energía química es una medida de la energía de interacción entre los átomos unidos y está relacionada con la distribución electrónica y el tipo de enlace. A la energía necesaria para romper un mol de enlaces se le llama energía de enlace. Naturalmente, al formarse un mol de enlaces se desprende la misma energía que hay que comunicar para romperlo, al tratarse de procesos contrarios.
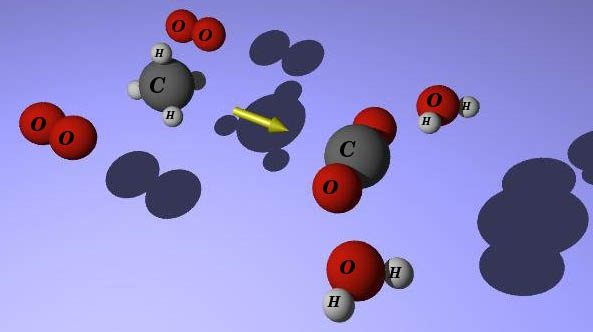
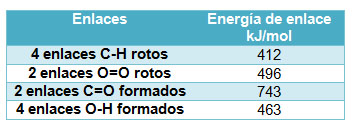
En la imagen puedes ver la combustión del metano. En la tabla siguiente se indica qué enlaces se rompen y cuáles se forman. Es necesario que recuerdes las estructuras de enlace en las sustancias que intervienen en el proceso.
Fíjate en la imagen. En el metano, el C está unido a cuatro H. Como al final está unido a dos oxígenos, hay que romper cuatro enlaces C-H, y también dos dobles enlaces O=O en las dos moléculas de oxígeno, O2. Además, se forman dos enlaces dobles C=O (en el CO2) y cuatro enlaces O-H en las dos moléculas de agua.
 |
 |
| Imagen 2 D.Gaya, Dominio público | Imagen 3 Elaboración propia |
Si la energía que hay que comunicar para romper los enlaces que mantienen unidos los átomos es mayor que la que se desprende cuando se forman los nuevos enlaces, en conjunto habrá que comunicar energía, y la reacción será endotérmica. En el caso contrario, se tratará de una reacción exotérmica.
Carácter térmico y energía de enlace
El hecho de que una reacción sea endo o exotérmica se debe a si hay que comunicar más o menos energía para romper los enlaces en los reactivos de la que se desprende cuando se forman los nuevos enlaces en los productos.