3.2 Transformaciones termodinámicas
Los sistemas termodinámicos no son estáticos, sino que están en
continua transformación, evolucionando entre distintos estados en lo
que se conoce como transformación termodinámica.
Aplicando el primer principio de la termodinámica es posible encontrar
expresiones simplificadas para las variables termodinámicas en los
procesos en los que una de ellas permanece constante.
Observa la siguiente simulación, que permite reproducir cuatro de estos procesos. Tendrás que fijar el campo indicado en la última línea y pulsar el botón de "Calcular" para comenzar el proceso.
Fíjate sobre todo en cómo cambia el valor del trabajo (W), calor (Q) y energía interna (U) en cada uno de los procesos. Repítelo para cada uno de los casos.
Animación 6. Ángel Franco
García con permiso de uso exclusivamente educativo.
Como habrás podido observar, las características básicas de cada una de estas transformaciones resultan ser:
1. Transformación isóbara (P = cte)
Es el tipo de transformación más común; de este tipo son todas las transformaciones que ocurren en recipientes abiertos a la atmósfera, como un tubo de ensayo. Están caracterizadas porque la presión no varía en el proceso. En ella se intercambia energía tanto en forma de calor como de trabajo:
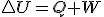
2. Transformación isócora (V = cte)
Una transformación es isocora cuando se produce en un recipiente cerrado, en el que no varía el volumen. Una olla a presión es un ejemplo típico de transformación isocóra. La característica principal de este tipo de transformaciones es que, al no haber desplazamiento, no se realiza trabajo y por tanto sólo se intercambia energía en forma de calor:
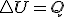
3. Transformación isotérmica (T = cte)
En una transformación isotérmica la temperatura del sistema no varía. Según la teoría cinética, si su temperatura no varía, la energía interna del sistema tampoco lo hace, por lo que en este tipo de transformaciones ΔU = 0 y entonces todo el calor transferido al sistema se utiliza en producir un trabajo:
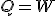
4. Transformación adiabática (Q = 0)
En este último tipo de transformaciones no se produce ningún intercambio de energía en forma de calor entre el sistema y su entorno y por ello el intercambio de energía se produce únicamente en forma de trabajo:
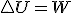
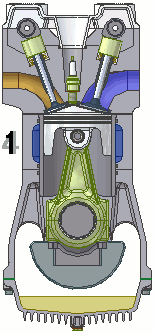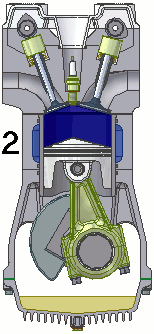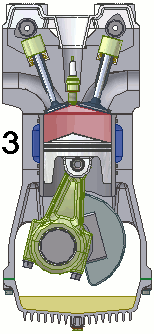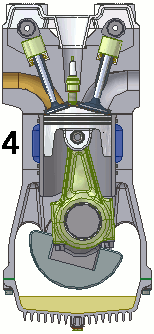
Funcionamiento de un motor de combustión
 |
| Animación 7. UtzonBike, Creative commons |
Un motor de combustión es una máquina termodinámica que sigue un proceso cíclico que, en el caso de motores de cuatro tiempos de gasolina, es el siguiente:
- Admisión: la mezcla de gasolina y aire entra al cilindro a través de la válvula de admisión, con la válvula de escape cerrada. Se trata de una expansión adiabática.
- Compresión: la válvula de admisión se cierra, el pistón comprime la mezcla y en el momento de máxima presión, la bujía produce una chispa que inflama la mezcla. Es una compresión.
- Explosión: con las válvulas cerradas, el gas caliente se expansiona, empujando el pistón y realizando trabajo. Esta etapa es otra expansión adiabática.
- Escape: el pistón asciende, empujando los gases hasta la válvula de escape, que ahora está abierta y expulsándolos. De nuevo se trata de una compresión. Al final de esta etapa, el motor queda preparado para la siguiente fase de admisión.
En la animación puedes observar el funcionamiento de un motor de gasolina de cuatro tiempos.
Dados los siguientes procesos, indica en cuál de ellos el calor intercambiado es mayor:
a) Transformación isocórica en la que su energía interna aumenta en 250 calorías.
Verdadero Falso
b) Compresión adiabática entre 2 atm y 5 atm.
Verdadero Falso
c) Expansión isotérmica con un trabajo realizado de 1000 J.
Verdadero Falso