3.1 Energía interna
En primer lugar hay que definir el concepto de energía interna, que será la contenida dentro de nuestro sistema, independientemente de sus interacciones con el entorno o su estado de movimiento. Por tanto:
Se denomina energía interna (U) de un sistema a la suma de las energías cinética y potencial de todas las partículas que lo componen. Debido a la gran cantidad de partículas involucradas, es imposible medir la energía interna de un sistema, por lo que únicamente pueden medirse las variaciones de la misma.
En el tema dedicado a la energía vimos que la energía total contenida en un sistema es constante, que se conserva en todo momento. Así podemos particularizar la ley de conservación de la energía a un sistema termodinámico aislado. En tal caso, no existe intercambio de materia con el entorno con lo que, según se ha visto, únicamente puede transferirse energía en forma de trabajo o de calor, lo que da lugar al enunciado del primer principio de la termodinámica:
La variación de la energía interna (U) de un sistema es igual a la suma de la energía suministrada en forma de trabajo (W) más la aportada en forma de calor (Q). Matemáticamente:
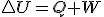
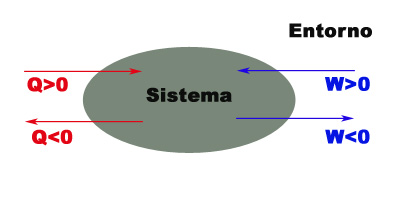
Resulta necesario establecer un convenio de signos para la energía intercambiada, en el que se considerará positivo todo intercambio de energía, ya sea en forma de trabajo o de calor, que aumente la energía interna del sistema, y negativo si la disminuye. Así:
- Si el entorno realiza un trabajo sobre el sistema, aumenta la energía interna del sistema y W > 0
- Si el sistema realiza un trabajo sobre el entorno, disminuye la energía interna del sistema y W < 0
- Si el sistema se calienta, aumenta la energía interna y por tanto Q > 0
- Si el sistema se enfría, la energía interna disminuye y Q < 0
En la imagen siguiente puedes observar gráficamente este convenio:
|
| Imagen 16. Elaboración propia |
Los sistemas termodinámicos no se caracterizan por tener trabajo ni calor, sino que tienen energía interna. Trabajo y calor simplemente son las formas de variar su energía interna.
Un recipiente contiene 200 g de aceite a 40 ºC de temperatura. Si el calor específico del aceite es ce_aceite = 1680 J/(kg·K), responde a las siguientes cuestiones:
a) Si mediante un agitador realizamos un trabajo de 5000 J y el sistema pierde hacia su entorno 5000 J en forma de calor, ¿cuál será el incremento en la energía interna del sistema? ¿Y la temperatura final del aceite?
b) Y si ahora aumentamos el trabajo realizado a 10000 J y el sistema sigue perdiendo hacia su entorno 5000 J en forma de calor, ¿cuál será el
incremento en la energía interna del sistema? ¿Y la temperatura final
del aceite?
Para refrigerar el agua de un depósito aislado que contiene 70 kg de agua a 85 ºC se añaden 30 kg de agua fría a 25 ºC.
Cuando se alcance el equilibrio, ¿cuál será la temperatura final de la mezcla? Dato: ce_agua = 4180 J/(kg·K)