2.3 Efectos del calor sobre los cuerpos
Aparte del lógico aumento de la temperatura en los cuerpos, cuando se calienta un cuerpo pueden producirse otra serie de efectos, entre los que destacan dos:
 |
| Imagen 12. Elaboración propia |
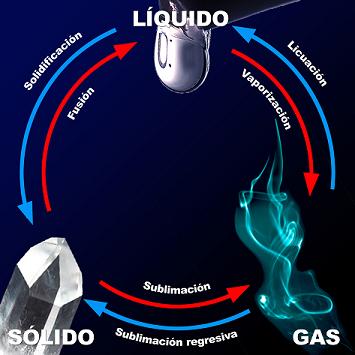
1) Cambios de estado
Al comunicar energía a una sustancia, según la teoría cinética de la materia aumenta la energía cinética de sus partículas, de forma que comienzan a moverse más rápidamente, siendo más probable que adquieran la energía necesaria como para vencer las fuerzas que las mantienen unidas, cambiando su configuración.
Cuando se calienta un sólido, las partículas que se encuentran en posiciones prácticamente fijas comienzan a vibrar con mayor amplitud y velocidad, hasta que se funde. Al alcanzar el punto de energía cinética máxima, la energía adicional se emplea en vencer las fuerzas que mantienen las partículas unidas entre sí, abandonando sus posiciones y pasando al estado líquido.
En este proceso de cambio de estado se produce un intercambio de calor, positivo en el caso de paso de sólido a líquido y negativo pero de igual valor que el anterior en el paso de líquido a sólido, que se utiliza en romper las uniones que mantienen unidas las partículas:
Se denomina calor latente (L) a la energía intercambiada para producir el cambio de estado de un kilogramo de materia:
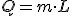
El calor latente se mide en J/kg.
 |
| Imagen 13. Proyecto Newton, Creative commons |
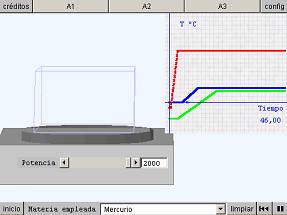
¿Qué energía se ha suministrado al hielo para efectuar esta transformación?
Datos: ce_hielo = 2100 J/(kg·K), ce_agua = 4180 J/(kg·K), Lfusión = 3.34·105 J/kg
Calcula la energía necesaria para evaporar totalmente 100 g de agua a 90 ºC.
Datos: ce_agua = 4180 J/(kg·K), Levaporación = 2.26·106 J/kg
 |
|
Imagen 14. Wadester16, |
2) Dilatación térmica
Al aumentar la energía cinética de las partículas, aumenta su movilidad lo que lleva asociado un incremento del tamaño del cuerpo; a este fenómeno se le denomina dilatación.
La dilatación se produce en todos los estados de la materia:
-
Dilatación de sólidos. Se caracteriza por el coeficiente de dilatación
lineal α, definido como el alargamiento por unidad de longitud producido
al aumentar la temperatura un grado:
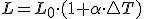 Este coeficiente es característico de cada material y se mide en K-1 en unidades del S.I.
Este coeficiente es característico de cada material y se mide en K-1 en unidades del S.I.
- Dilatación de líquidos. Los líquidos se dilatan más que los sólidos, pero sabemos que toman la forma del recipiente que los contiene, que a su vez también se dilata, por lo cual su dilatación real será la resultante de la dilatación del líquido menos la del recipiente.
- Dilatación de gases. Los gases se dilatan aún más que los líquidos, aunque, a diferencia de éstos, todos los gases se dilatan por igual.
 |
| Imagen 15. Elaboración propia |
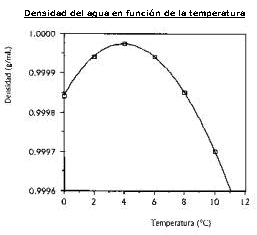
Dilatación anómala del agua
El agua, a diferencia de la mayor parte de sustancias, disminuye de volumen con el aumento de temperatura en el intervalo entre 0 ºC y 4 ºC . Dicho en otras palabras, en este intervalo el coeficiente de dilatación del agua es negativo. Lo mismo ocurre cuando se congela.
Este comportamiento es fundamental en la vida en la Tierra, ya que cuando un lago se enfría, el agua fría de la superficie desciende al fondo por su mayor densidad; ahora bien, cuando la temperatura llega a los 4 ºC este movimiento cesa. Además, como el hielo es menos denso que el agua, flota y actúa como aislante evitando que siga perdiéndose calor. Esto provoca que los lagos se congelen más fácilmente y permite que los seres vivos que soportan bien el agua fría pero no el hielo continúen con vida. Este hecho fue básico durante las glaciaciones para evitar la extinción de numerosas especies.