2.1 Medida del calor transferido
Cuando se transfiere energía en forma de calor a un cuerpo, su temperatura aumenta como consecuencia del incremento de la energía cinética media de sus partículas. Como en cualquier disciplina científica, es necesario poder cuantificar esta transferencia para realizar cálculos y predicciones en aquellas circunstancias en las que interviene el calor.
Dado que, como se ha visto, el calor es una forma de energía, su unidad en el sistema internacional será el julio (J), aunque existe otra unidad de uso habitual en la medida del calor: la caloría.
El calor se mide en el S.I. en julios (J), pero también en calorías (cal). Una caloría se define como la energía necesaria para elevar un grado la temperatura de un gramo de agua. La relación entre julio y caloría es:
1 cal = 4.18 J
 |
| Imagen 7. Proyecto Newton, Creative commons |
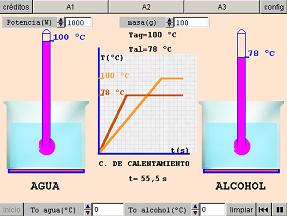
Vas a realizar una experiencia, en la que suministrarás la misma cantidad de calor a dos recipientes que contienen igual masa de alcohol y agua. Para ello, abre la siguiente animación. Para comenzar debes pulsar el botón Play de la parte inferior derecha.
A la vista de los resultados, ¿se calientan de la misma manera ambas sustancias? ¿Cuál se calienta más rápidamente?
Si tienes dudas para responder, repite otra vez la experiencia, pulsando el botón de inicio. Observarás que el alcohol aumenta significativamente más rápido su temperatura, hasta que alcanza su temperatura de ebullición, momento en el que cesa de aumentar. Análogamente ocurre con el agua, que se calienta más lentamente y tiene un punto de ebullición más alto.
Puedes obtener la misma información interpretando la gráfica de calentamiento.
Por tanto, es necesario introducir una nueva magnitud que exprese el diferente comportamiento de las sustancias al ser calentadas.
Si se transfiere una misma cantidad de calor a dos sistemas distintos,
el aumento de temperatura experimentado por cada uno de ellos no es
siempre el mismo, sino que depende de su naturaleza y composición. El
parámetro que relaciona el incremento de la temperatura con el calor
suministrado se denomina calor específico (ce),
definido como la energía absorbida al calentarse por un kilogramo de
una sustancia para elevar su temperatura un grado, y es característico
de cada sustancia. El calor específico se mide en el S.I. en J/(kg·K).
El aumento de temperatura viene dado por tanto por el cociente: 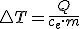 , de modo que el calor intercambiado puede escribirse como:
, de modo que el calor intercambiado puede escribirse como: 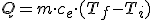
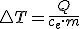 , de modo que el calor intercambiado puede escribirse como:
, de modo que el calor intercambiado puede escribirse como: 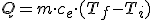
La energía transferida a un cuerpo de masa m para que su temperatura pase de una inicial (Ti) a otra final (Tf) viene dada por la expresión:
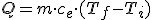
donde ce es el calor específico de la sustancia en cuestión.
Destacar también que, debido a que aparece una diferencia de temperaturas, es equivalente utilizar la escala Kelvin que la Celsius, pues según se ha visto, ambos grados son equivalentes.
Esta relación explica por qué es necesario suministrar más calor a unas sustancias que a otras para aumentar su temperatura: cuanto mayor sea su calor específico, más energía será necesario suministrar. Por ejemplo, los metales tienen un calor específico relativamente bajo, mientras que la madera o el agua lo tienen elevado.
Una cacerola contiene medio litro de agua a 25 ºC. Si el calor específico del agua es de 4180 J/(kg·K), calcula la cantidad de energía necesaria para llevar todo el agua a la temperatura de ebullición (100 ºC).
Cuando suministramos 67500 J en forma de calor a un bloque de acero, observamos que su temperatura aumenta 75 ºC. Si el calor específico del acero es de 450 J/(kg·K), ¿cuál es la masa del bloque?