2. Redes cristalinas.
 Después de mirar muchos materiales con su "lupa", nuestro protagonista se ha dado cuenta de que casi todos los materiales metálicos que ha observado tienen una estructura ordenada, bien dicho, cristalina.
Después de mirar muchos materiales con su "lupa", nuestro protagonista se ha dado cuenta de que casi todos los materiales metálicos que ha observado tienen una estructura ordenada, bien dicho, cristalina.
En general los sólidos de la naturaleza son cristalinos lo que implica que los iones, átomos o moléculas que los constituyen se ordenan geométricamente en el espacio. En ocasiones esta estructura ordenada no es apreciable a simple vista porque están formados por una agrupación de microcristales orientados de formas diversas dando lugar a estructuras policristalinas, aparentemente amorfas.
|
| Imagen 10 . E.L.U.E. Creative Commons |
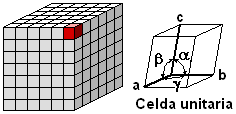
La estructura interna de los cristales viene representada por la llamada celdilla unidad o elemental que es el menor conjunto de átomos que mantienen las mismas propiedades geométricas de la red y que al expandirse en las tres direcciones del espacio constituyen una red cristalina.
El tamaño de esta celdilla viene determinado por la longitud de sus tres aristas (a, b, c), y la forma por el valor de los ángulos entre dichas aristas ( α, β , γ ).
 |
| Imagen 11. Wikimedia. Creative Commons. |
|
Celdillas unidad.
| |
|
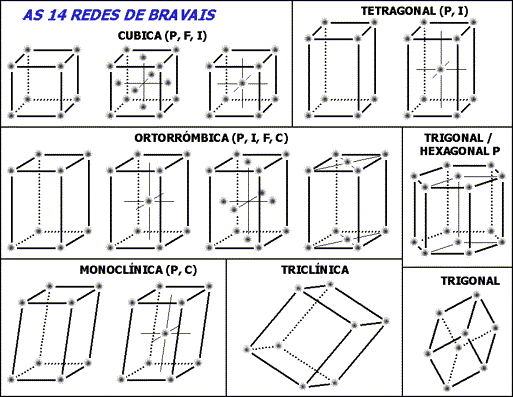
Redes de Bravais.
| |
|
Microcristales.
|
De las catorce redes de Bravais, casi todos los metales elementales y aleaciones metálicas, cistalizan en los siguientes tres tipos:
BCC, FCC y HCP
 |
| Imagen 12. Wikimedia. Creative Commons. |
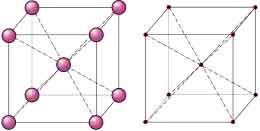
Red Cúbica Centrada en el Cuerpo (BCC, Body Centred Cubic)
La red representa un cubo cuyo parámetros son:
- aristas: a = b = c
- ángulos entre aristas: α = β = γ = 90°
- cantidad de átomos: 8 átomos en los vértices del cubo y 1 átomo en el centro del cubo.
EJEMPLOS: Feα, Mo, Na, ...
Animación de una red BCC, procedente de McMaster University
|
|
| Multimedia 02. Youtube Creative Commons. |
 |
| Imagen 13 . Wikimedia. Creative Commons. |
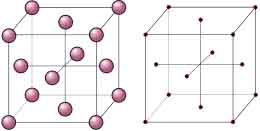
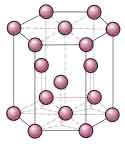
Red Cúbica centrada en las Caras (FCC, Face Centred Cubic)
La red tiene forma de cubo, cuyos parámetros son:
- aristas: a = b = c
- ángulos entre aristas: α = β = γ = 90°
- cantidad de átomos: 8 átomos en los vértices del cubo y 6 en los centros de cada una de las caras.
EJEMPLOS: Feγ, Ni, Co, Cu, Al, Ti, ...
|
| Imagen 14 . Wikimedia. Creative Commons. |
Red Hexagonal Compacta (HCP, Hexagonal Close Packing)
La red tiene forma de prisma recto de base es un hexaedro, cuyos parámetros son:
- aristas: a = b ≠ c
- ángulos entre aristas: α = β = 90°; γ = 120°
- cantidad de átomos: 12 átomos están dispuestos en los vértices de la red, 2 átomos en el centro de la base y 3 átomos en el interior de la red.
EJEMPLOS: Ti, Co, Cd, Mg, ...
Animación de una red HCP, procedente de McMaster University
|
|
| Multimedia 04. Youtube Creative Commons. |
Verdadero Falso
Verdadero Falso
Verdadero Falso