3.1 Influencia de la temperatura
|
|
| Simulación 2 Proyecto TIGER, Uso educativo |
El dato experimental más inmediato que se conoce sobre las reacciones químicas es que la velocidad de reacción aumenta con la temperatura. En general, al aumentar la temperatura unos 10 Kelvin, la velocidad varía en un factor comprendido entre 1,5 y 5.
Al aumentar la temperatura también lo hace la energía de las partículas que reaccionan, con lo que una fracción mayor de partículas tienen energía suficiente para superar la barrera de energía, por lo que aumenta la velocidad de reacción.
La relación entre la constante de velocidad K y la temperatura se descubrió por procedimientos experimentales (Arrhenius, 1899). Esta relación se conoce con el nombre de ley de Arrhenius y su expresión matemática es:
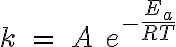
donde A es una constante llamada factor de frecuencia, R la constante de los gases ideales (expresada en unidades de energía), T la temperatura absoluta y Ea la energía de activación de la reacción.
La inclusión del término Ea en la expresión es debida a que prácticamente en todas las reacciones es necesario que las moléculas o partículas que colisionan (reaccionan) lo hagan "activamente", esto es, con suficiente energía como para romper sus enlaces.
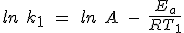
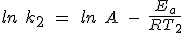
Dividiendo la segunda igualdad por la primera y operando resulta que:
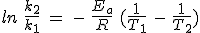
Esta misma expresión permite calcular la constante de velocidad para cualquier temperatura conociendo Ea y la constante a otra temperatura.
¿Cuánto vale la barrera de energía?
Para saberlo, solamente has de considerar que hay muchas reacciones que aproximadamente duplican su velocidad al aumentar la temperatura en 10 K, partiendo de temperatura ambiente. Si la velocidad de reacción es doble, es que la k se ha hecho doble. Sustituyendo en la ecuación que acabas de ver:
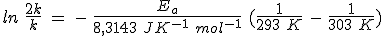
Resolviendo, la energía de activación en esas condiciones es de unos 50 kJ (el resultado es 51,2 kJ).
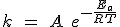 . De acuerdo con esta expresión, al aumentar la energía de activación, Ea, el exponente se hace más negativo, con lo que disminuye
. De acuerdo con esta expresión, al aumentar la energía de activación, Ea, el exponente se hace más negativo, con lo que disminuye 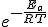 , y, por tanto, disminuye k.
, y, por tanto, disminuye k.